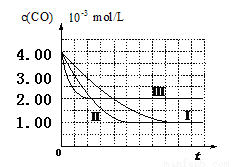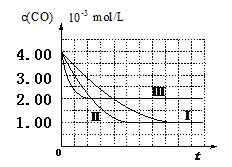-
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | 6.50×10-3 | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
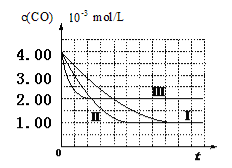 【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
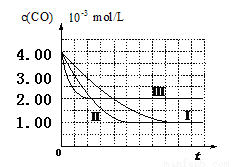
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
-
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。

【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
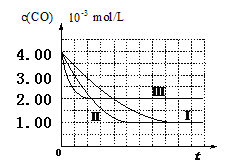
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________; NO 的转化率为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热(与外界没有热交换)、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变 B.容器内温度不再变化 C.断裂1mol N≡N键的同时,生成6 mol N—H键 D. 2v正(H2)=3v逆(NH3) E.反应混合气体的平均相对分子质量不变 F.C(H2): C(N2): C(NH3)= 3:1:2
-
(10分)(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
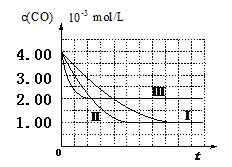
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下: 2NO + 2CO
2NO + 2CO 2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |


 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1) 前3s的平均反应速率v(N2)=_____________。(答案保留2位小数)
(1) 前3s的平均反应速率v(N2)=_____________。(答案保留2位小数)
(2) 计算4s时CO的转化率α = 。
 (3) 下列措施能提高NO和CO转变成CO2和N2的反应速率的是( )
(3) 下列措施能提高NO和CO转变成CO2和N2的反应速率的是( )
 A.选用更有效的催化剂 B.升高反应体系的温度
A.选用更有效的催化剂 B.升高反应体系的温度
 C.降低反应体系的温度 D.缩小容器的体积
C.降低反应体系的温度 D.缩小容器的体积
 (4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/ mol·L-1 | 催化剂的比表面积/m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |

 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
 ②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。

-
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和 CO,测得不同时间的NO和CO的浓度如下表:
CO,测得不同时间的NO和CO的浓度如下表:
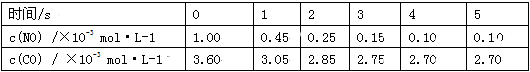
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
B.在该温度下,反应的平衡常数K=15
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以提高单位时间CO和NO的处理量
-
(16分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂 的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4. 00×10-3 | 80 |
| Ⅱ | ① | ② | ③ | ④ | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | ⑤ | ⑥ | 80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:

(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”);
-
(12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | | | 80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:

(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
-
汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
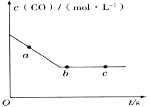
则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
(资料查阅)A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验:
| 实验编号 | 实验目的 | T/℃ | NO初始浓度/(mol/L) | CO初始浓度/(mol/L) | 同种催化剂的比表面积/(m2/g) | c(CO)不变时所用的时间/min |
| Ⅰ | 参照实验 | 280 | 6.50×10-5 | 4.00×10-3 | 80 | t |
| Ⅱ | | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t |
| Ⅲ | | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(结论)
① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______, 且_______反应速率将_______(填“增大”“减小”或“无影响”)。
-
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________,N2的电子式___________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
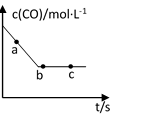
①则反应速率υ(a)、υ(b)、 υ(c)的大小关系是______________;
②下列可说明反应到达图中c点的是__________;
A.NO、CO、CO2、N2表示的速率比值保持2︰2︰2︰1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t |
| Ⅲ | | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】①实验编号Ⅱ的实验目的为_________________________。
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是___________,且____________反应速率将___________。(填“增大”、“减小”、“无影响”)。
-
NO和CO都是汽车尾气里的有害物质,它们能缓缓地反应生成N2和CO2,化学方程式为2NO+2CO N2+2CO2,对此反应,下列叙述错误的是( )
N2+2CO2,对此反应,下列叙述错误的是( )
A. 使用正催化剂能加大反应速率
B. 改变反应物的压强对反应速率产生影响
C. 冬天气温低,反应速率降低,对人体危害更大
D. 无论外界条件怎样改变,均对此化学反应的速率无影响
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。


2NH3
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
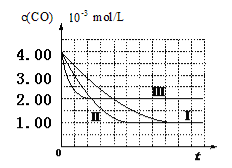 【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下: