-
化学实验安全处理不正确的是( )
A. 苯酚沾在皮肤上用大量水冲洗
B. 金属钠着火时,立即用沙子盖灭
C. 制备氯气时,应用NaOH溶液吸收多余的氯气
D. 制备乙烯时向乙醇和浓硫酸的混合液中加碎瓷片
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A. 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H>0
B. 等pH的CH3COOH、HCl溶液混合后,平衡不移动,但c(CH3COO-)减少
C. 配制KF溶液时,必需要加入KOH溶液抑制F-水解
D. 向NaHS溶液中滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度增大,pH减小
难度: 中等查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
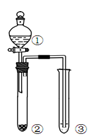
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列与化学有关说法中正确的是( )
A.
和
互为同位素
B. lmol碳酸钾晶体中含阴离子数为等于NA个
C. 分子式为C4H8O2的羧酸共有3种
D. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
难度: 中等查看答案及解析
-
在某温度时,将nmol·L-1醋酸溶液滴入10mL1.0 mol·L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
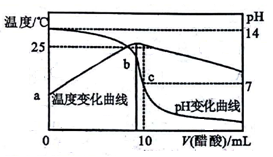
A. 水的电离程度:c>b B. a点Kw比b点大
C. n>1.0 D. c点:Ka(CH3COOH)=
难度: 中等查看答案及解析
-
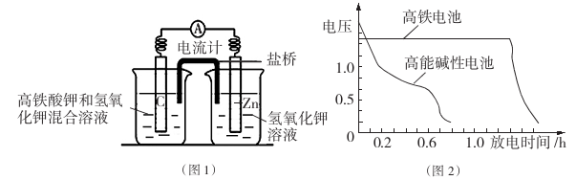
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始浓度和起始容积相同,一定条件下发生反应:N2(g)+3H2(g)
2NH3(g) △H
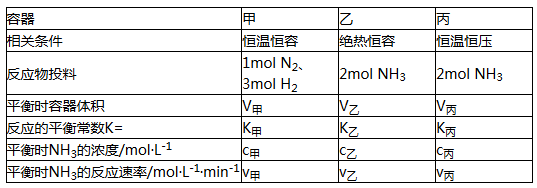
下列说法正确的是( )
A. V甲>V乙 B. K丙>K乙 C. V甲=V丙 D. c乙>c甲
难度: 中等查看答案及解析
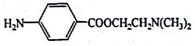 )可用作临床麻醉剂,熔点约60℃。它的一条合成路线如下图所示(部分反应试剂和条件己省略):
)可用作临床麻醉剂,熔点约60℃。它的一条合成路线如下图所示(部分反应试剂和条件己省略):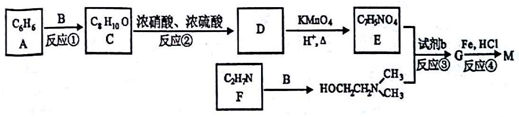
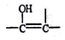 的结构不稳定。
的结构不稳定。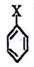 ,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位。参照上述合成路线,设计由甲苯合成
,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位。参照上述合成路线,设计由甲苯合成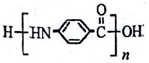 的合成路线_______。(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选)。
的合成路线_______。(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选)。