-
哥本哈根气候大会的中心议题是“节能减排”,美国二氧化碳排放量居世界之首,人均年排放CO2约20吨,20吨CO2在标准状况下的体积为
A.2×107L B.
L C.2×107×22.4 L D.
×22.4 L
难度: 简单查看答案及解析
-
下列实验操作或记录正确的是
A.常温常压下测得1 mol N2的质量为28 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
难度: 简单查看答案及解析
-
下列各原子或离子的电子排列式错误的是
A. Na+ 1s22s22p6 B.F¯ 1s22s22p6 C. N3+ 1s22s22p6 D. O2¯ 1s22s22p6
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 简单查看答案及解析
-
根据下列热化学方程式:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH 3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.ΔH =+244.1 kJ/mol B.ΔH =-488.3 kJ/mol
C.ΔH =-996.6 kJ/mol D.ΔH =+996.6 kJ/mol
难度: 简单查看答案及解析
-
下列实验操作或装置不符合实验要求的是
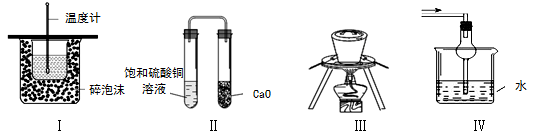
A.装置Ⅰ可用于测定中和热
B.装置Ⅱ久置后,饱和硫酸铜溶液可能析出蓝色晶体
C.装置Ⅲ在海带提碘实验中用于灼烧海带
D.装置Ⅳ可用于吸收易溶于水的尾气
难度: 简单查看答案及解析
-
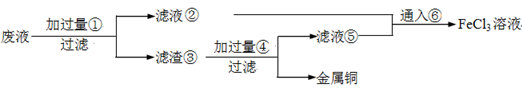
下列各组物质按右图所示转化关系每一步都能一步实现的是
甲
乙
丙
丁
A
FeCl3
FeCl2
Fe2O3
Fe(OH)3
B
Cu
CuO
CuSO4
CuCl2
C
S
SO2
SO3
H2SO4
D
NH3
NO
NO2
HNO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol碳烯(:CH2)中含有的电子数为6NA
B.3.2 g铜与足量硫加热充分反应,电子转移总数为0.1NA
C.100mL 0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01NA
D.常温常压下,甘油(C3H8O3)和甲苯(C7H8)的混合物46g中含有4NA个氢原子
难度: 简单查看答案及解析
-
能正确解释下列反应原理的离子方程式是
A.用小苏打治疗胃酸过多:CO32- + 2H+ === CO2↑ + H2O
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- === 3BaSO4↓ + 2Al(OH)3↓
C.大理石溶于醋酸中:CaCO3 + 2H+ === Ca2+ + CO2↑ + H2O
D.稀硝酸中加入过量的铁粉:Fe + 4H+ + NO3- === Fe2+ + NO↑ + 2H2O
难度: 简单查看答案及解析
-
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式为:Ni2++2e- = Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
难度: 简单查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
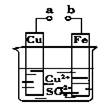
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 简单查看答案及解析
-
下列制备气体的实验设计中错误的是
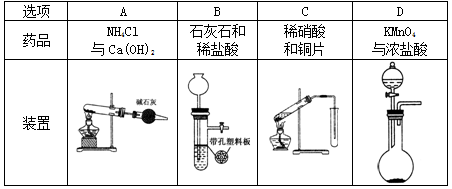
难度: 简单查看答案及解析
-
大多数天然元素存在几种稳定的同位素。许多同位素有重要的用途,例如
是作为确定原子量标准的原子;
、
是制造氢弹的材料;
是制造原子弹的材料和核反应堆的原料。同位素示踪法广泛应用于科学研究、工农业生产和医疗技术方面,例如用
标记化合物确证了酯化反应的历程,
用于甲状腺吸碘机能的实验等。下列说法中正确的是
A.
、
互为同位素
B.分子是保持物质化学性质的唯一微粒
C.同种元素的各种同位素原子的质量不同,但化学性质几乎相同
D.题干中涉及了五种具体的核素
难度: 简单查看答案及解析
-
以下说法正确的是
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素的原子间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
难度: 简单查看答案及解析
-
某无色透明的混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对于原混合气体成分的判断中正确的是
A.肯定有SO2、O2和NO B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
难度: 简单查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在元素周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是
A.Y、Z和W三种元素可能位于同一周期
B.上述元素形成的氢化物中, W的氢化物相对分子质量最大,熔、沸点最高
C.Y和W所形成的含氧酸均为强酸
D.X、Y、Z和W可以组成原子的物质的量之比为5∶1∶4∶1的离子化合物
难度: 简单查看答案及解析