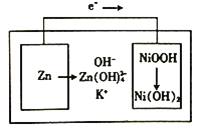
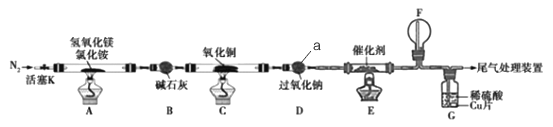
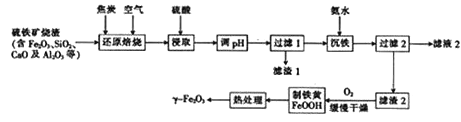
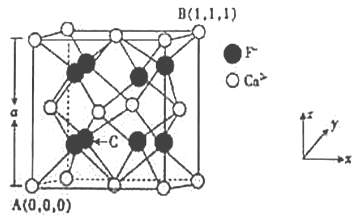
-
化学与生活、社会密切相关,下列说法正确的是( )
A. 将矿物燃料脱硫脱硝可有效防止酸雨
B. 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C. 高锰酸钾溶液、酒精、双氧水能杀菌消毒,都利用了强氧化性
D. 以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
难度: 中等查看答案及解析
-
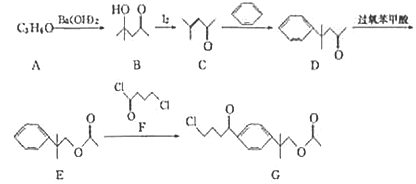
下列关于有机物的说法中正确的是
A. 糖类、油脂和蛋白质都可水解
B. 苯能与溴水发生加成反应
C. 以苯甲醇为原料可制取苯甲酸
D. 分子式为C4H9Br的有机物共有5种结构
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述不正确的是
A. 0.5 mol/L的AlCl3溶液中含有Al3+的数目小于0.5NA
B. 标准状况下,22.4 L丁烷中含有共价键的数目为13NA
C. 44 g由CO2 和N2O组成的混合气体中含有的质子数为22NA
D. 将1mol N2 与3 mol H2 通入密闭容器中充分反应、转移的电子数小于6NA
难度: 中等查看答案及解析
-
下列实验操作规范且能达到相应实验目的的是
选项
实验目的
实验操作
A
取20.00 mL KMnO4溶液
从碱式滴定管初始读数为1.00 放液体到最终读数为21.00
B
分离KClO3与MnO2制O2后的残渣
溶解,过滤、洗涤、干燥滤渣得到MnO2,滤液蒸发结晶并干燥得到KCl
C
证明Ksp (BaSO4)<Ksp (BaCO3)
向BaSO4悬浊液中通入足量CO2
D
配制 100 mL 1.8 mol/L 硫酸
量取10mL 18mol/L浓硫酸,倒入100 mL容量瓶中,然后加水稀释至刻度
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z在周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列说法正确的是
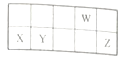
A. X的简单离子与Z的简单离子具有相同的电子层结构
B. 最简单氢化物的稳定性:W>Y
C. 原子半径:Y>X
D. 化合物YW2和YZ4中均含有离子键
难度: 中等查看答案及解析
-
25 ℃时,体积均为20 mL、浓度均为0.1 mol • L-1的两种酸HX、HY分别与0.1 mol • L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是

A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
难度: 中等查看答案及解析