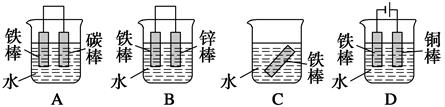
-
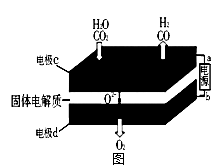
科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步。下列说法正确的是 ( )
A、使用二氧化钛作催化剂使水快速分解的同时放出大量热
B、催化剂的作用是降低反应所需要达到的活化能来增大反应的速率
C、该反应的原理是:2H2O
2H2+ O2
D、每产生氢气44.8L,转移电子数目为4NA
难度: 中等查看答案及解析
-
对于:2H2(g) + O2(g) =2H2O(l)的叙述错误的是( )
A.该反应的反应热为△H = —571.6kJ/mol ,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ
D.该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol
难度: 中等查看答案及解析
-
在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A .v(A)=0.5mol•L﹣1.min﹣1 B.v(B)=0.3mol•L﹣1.min﹣1
C.v(C)=0.8mol•L﹣1.min﹣1 D.v(D)=1.0mol•L﹣1.min﹣1
难度: 中等查看答案及解析
-
用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较
D.试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A、铝制品的耐腐蚀性强,说明铝的化学性质不活泼
B、铁板上镀锡属于电化学防护
C、生铁中含有碳,抗腐蚀能力比纯铁强
D、将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀
难度: 中等查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是 ( )
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)===
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
已知H2 (g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8 kJ·mlo-1,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
难度: 困难查看答案及解析
-
关于甲酸(HCOOH)的下列性质中,不能证明它是弱电解质的是( )
A.把pH=2的甲酸溶液稀释100倍后pH=3.5
B.0.1 mol·L-1的甲酸溶液的pH约为2
C.甲酸钠HCOONa溶液能使酚酞试液变红
D.50mL l mol·L-1的甲酸溶液恰好与50mL l mol·L-1的NaOH溶液完全反应
难度: 中等查看答案及解析
-
已知下列数据:
Fe(s)+
O2(g)=FeO(s) △H=-272kJ·mol-1
2Al(s)+
O2(g)=Al2O3(s) △H=-1675kJ·mol-1
则2Al(s) +3FeO(s)=Al2O3(s) + 3Fe(s)的△H是
A.+859 kJ·mol-1 B.-859 kJ·mol-1
C.-1403 kJ·mol-1 D.-2491 kJ·mol-1
难度: 中等查看答案及解析
-
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2十H2O = ZnO + 2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2e一+ 2H2O = 2MnO (OH)十2OH-
难度: 困难查看答案及解析
-
25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是( )
A.①=②=③=④ B.①>③>②>④
C.④=②>③=① D.①=③>②=④
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子完全沉淀
C.难溶电解质的溶解平衡是一种动态平衡
D.AgCl固体在等浓度的NaCl、CaCl2溶液中的溶解度相同
难度: 简单查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
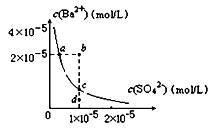
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
难度: 中等查看答案及解析
-
若pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液呈碱性,其原因可能( )
A.反应后盐水解使溶液呈碱性 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
难度: 中等查看答案及解析
-
如图为反应2X(g)+Y(s)
2Z(g)的反应过程和能量关系图,下列说法正确的是( )
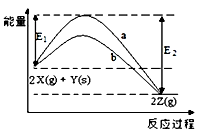
A.曲线a和b表示两个反应过程的反应热不同
B.曲线a一定表示反应是在无催化剂时的反应过程
C.增大压强,X的转化率一定增大
D.反应达平衡,升高温度,平衡常数K值一定减小
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为放热反应,下列说法正确的( )
A.X的能量一定高于M B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于N D.因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是( )
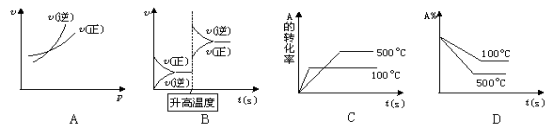
难度: 简单查看答案及解析
-
由氢气和氧气反应生成1 mol水蒸气放出241.8 kJ的热量,1 g水蒸气转化为液态水放出2.45 kJ的热量,则下列热化学方程式书写正确的是( )
A. H2(g)+1/2O2(g)===H2O(l) ΔH=-285.9 kJ·mol-1
B. H2(g)+1/2O2(g)===H2O(l) ΔH=-241.8 kJ·mol-1
C. H2(g)+1/2O2(g)===H2O(l) ΔH=+285.9 kJ·mol-1
D. H2(g)+1/2O2(g)===H2O(g) ΔH=+241.8 kJ·mol-1
难度: 中等查看答案及解析
-
反应2A(g)
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压 B.减压 C.减少E的浓度 D.降温
难度: 简单查看答案及解析