-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
①硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
②Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
③向Na2CO3和Na2S混合溶液中通人SO2可制得Na2S2O3(反应方程式为: ,所得产品常含有少量Na2SO3和Na2SO4。
,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:

(1)实验步骤:检查装置气密性后,向三颈瓶c中加人Na2CO3和Na2S的混舍溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____(填操作名称)、过滤、洗涤、干燥、得到产品。
(2)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是_________。
III.【测定产品纯度】
称取10g产品(Na2S2O3·5H2O),配成250mL溶液,取25mL,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。反应原理为: (忽略Na2SO3与I2反应)。
(忽略Na2SO3与I2反应)。
(3)滴定至终点的现象为:____。
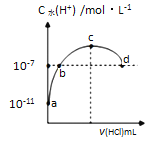
(4)重复三次的实验数据如左下表所示,其中第三次读数时滴定管中起始和终点的液面位置如右下图所示,则x=___mL,产品的纯度为____。

IV.【探究与反思】
(5)为验证产品中含有Na2SO3和Na2SO4该小组设计了以下实验方案,请将方案补充完整(所需试剂从稀HN03、稀H2SO4、稀盐酸、蒸馏水中选择):取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____,则可确定产品中含有Na2SO3和Na2SO4。
-
三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4).再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
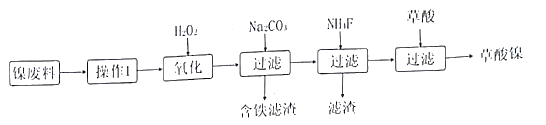
请回答下列问题:
(1)操作I为____。加入H2O2发生的主要反应的离子方程式为_____;加入碳酸钠溶液调节pH至4.0一5.0,其目的为______。
(2)若加入NH4F时滤液中c(Mg2+)=0.02 mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____。
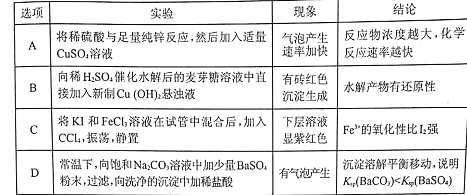
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO -,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____。
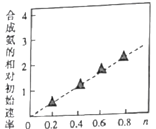
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____。
-
氮、磷、砷(As)等VA族元素的化合物在研究和生产中有许多重要用途。
(1)写出基态As原子的核外电子排布式___________________。
(2)NH3、PH3、AsH3熔沸点由高到低的顺序为______。
(3)水合肼(N2H4·H2O)又名水合联氨,是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+ 2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCL,该反应中所涉及的第二周期元素第一电离能大小顺序是________。晶体N2H4·H2O中各种微粒间的作用力不涉及__(填字母)。
a:离子键 b.共价键 c.金属键 d.氢键 e.范德华力
(4)NO3-的VSEPR模型是____,H3AsO3分子中As的杂化方式为____。
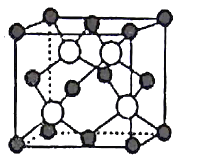
(5)GaAs以第三代半导体著称,性能比硅更优良,广泛用于电子计算机、人造卫星等尖端技术。它的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。GaAs为___ 晶体,晶胞结构与NaCl晶胞____(填“相同”或“不同”)。Ga和As的摩尔质量分别为MGag·mol-l和MAsg·mol-l,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___ 。
-
【化学一选修5:有机化学基础】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
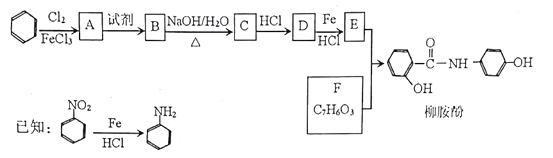
回答下列问题:
(1)F的化学名称____,由E和F生成柳胺酚的反应类型是____。
(2)写出由A生成B反应所需的试剂_____。
(3)写出由B生成C的化学方程式____。
(4)对于柳胺酚,下列说法正确的是____。
a.可发生水解反应 b.不发生硝化反应
c.1 mol柳胺酚最多可以和2molNaOH反应 d.可与溴发生取代反应
(5)写出所有同时符合下列条件的F的同分异构体的结构简式_________。
①苯环上有2种不同化学环境的氢原子;②能发生银镜反应;③能与FeCl3发生显色反应
(6)4-甲氧基乙酰苯胺( )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( )与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
)与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:

和
组成的超重水中,含有的中子数目为5NA
)、b(
 )、c(
)、c()的说法正确的是
 ,所得产品常含有少量Na2SO3和Na2SO4。
,所得产品常含有少量Na2SO3和Na2SO4。
 (忽略Na2SO3与I2反应)。
(忽略Na2SO3与I2反应)。




 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( )与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
)与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图: