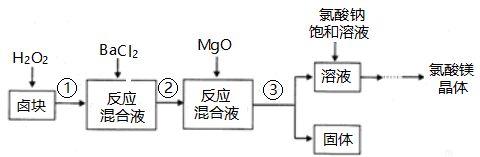
-
国庆期间,我市著名景点芙蓉洞每天接待游客上万,其中美不胜收的石笋、石钟乳和石柱等均为石灰石,石灰石的主要成分是:
A. Ca(OH)2 B. CaCO3 C. CaO D. CaSO4
难度: 中等查看答案及解析
-
化合价是学习氧化还原反应的基础。下列化合物中,加点元素的化合价错误的是:
A. CaCO3 (+4) B. H2C2O4 (+3)
C. Na2O2 (-2) D. NH4NO3 (-3)
难度: 中等查看答案及解析
-
记住酸碱盐的溶解性对书写离子方程式很有帮助。下列物质中难溶于水的是:
A. FeSO4 B. CaCl2 C. H2SiO3 D. NaClO3
难度: 中等查看答案及解析
-
下列过程中,不涉及化学变化的是:
A. 液氨用作制冷剂 B. 从海带中提取碘
C. 铁和铝遇到浓硝酸钝化 D. 以黏土为原料高温烧制瓷砖
难度: 中等查看答案及解析
-
SO2 既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是:
① SO2使溴水褪色 (还原性) ② SO2使品红溶液褪色 (漂白性)
③ SO2通入氢硫酸(H2S)产生淡黄色浑浊 (氧化性)
④ SO2使润湿的蓝色石蕊试纸变红 (水溶液酸性)
A. 只有①②④ B. 只有③④ C. 只有①③ D. ①②③④
难度: 中等查看答案及解析
-
下列关于氢氧化铁胶体的说法不正确的是:
A. 往NaOH饱和溶液中滴加FeCl3饱和溶液,加热煮沸制备氢氧化铁胶体
B. 氢氧化铁胶体的胶粒大小在1-100nm之间
C. 氢氧化铁胶体可发生丁达尔效应
D. 往氢氧化铁胶体中滴加电解质溶液可发生聚沉现象
难度: 中等查看答案及解析
-
下列实验操作中,正确的是:
A. 为增大气体物质的溶解度,常采取搅拌、加热等措施
B. 用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上
C. 用点燃的方法除去CO2中少量的CO
D. 为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动
难度: 中等查看答案及解析
-
下列实验操作中,能达到实验目的的是:
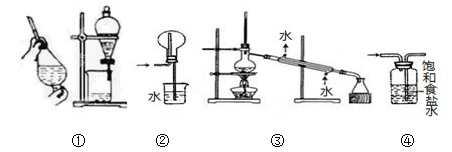
A. 装置①用于CCl4萃取KI水溶液中的碘
B. 装置②用于收集NH3
C. 装置③可用于制取蒸馏水
D. 装置④用于洗去Cl2中含有的少量HCl
难度: 困难查看答案及解析
-
下列离子方程式错误的是:
A. NaHCO3溶液与NaOH溶液反应:HCO3
+ OH
= H2O + CO32
B. 铁钉溶于稀盐酸:2Fe + 6H+ = 3H2↑ + 2Fe3+
C. 钠与水的反应:2Na + 2H2O =2Na ++2OH-+ H2↑
D. 铝片溶解于烧碱溶液中:2Al + 2OH-+2H2O = 2AlO2- + 3H2↑
难度: 中等查看答案及解析
-
某无色强酸性溶液中已经检出了大量的NO3-,则其中还可能大量存在的离子是:
A. CO32- B. Fe3+ C. S2- D. NH4+
难度: 中等查看答案及解析
-
实验室通常悬挂涂有CuI的滤纸监测空气中汞蒸气的含量,监测原理为:4CuI + Hg = Cu2HgI4 +2Cu下列叙述正确的是:
A. 在Cu2HgI4中I的化合价为-2价 B. 4mol CuI反应中失去4mol电子
C. 该反应中Hg 是还原剂 D. CuI既是氧化剂又是还原剂
难度: 困难查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是:
A. 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
难度: 困难查看答案及解析
-
将4.79 g Na2CO3·x H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)为0.5 mol/L。再取同质量的混合物,加入足量的盐酸 ,充分加热蒸干至质量不变时,所得固体的质量为:
A. 2.65g B. 3.89g C. 3.36g D. 5.85g
难度: 困难查看答案及解析
-
某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr
六种微粒,氧化剂和还原剂的物质的量之比为1:3。下列判断错误的是:
A. 反应的氧化产物是NO3-
B. 反应过程中溶液pH变化如图所示
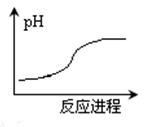
C. 消耗l mol氧化剂,转移电子6 mol
D. 反应中Cr
被氧化
难度: 困难查看答案及解析