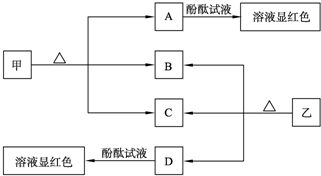
-
2011年被第63届联合国大会定为“国际化学年”.联合国教科文组织指出,化学在开发可替代能源、保护环境等方面起到主要作用.下列措施中,不利于节能减排和改善环境的是( )
A.推广可利用太阳能、风能的城市照明系统
B.使用填埋法处理未经分类的生活垃圾
C.加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
D.积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.含金属元素的离子不一定是阳离子
B.只有原子才满足核内质子数和核外电子数相等
C.由同种元素组成的物质肯定属于纯净物
D.具有相同质子数的粒子都属于同种元素难度: 中等查看答案及解析
-
医学界通过用14C标记的C60发现一种羧酸衍生物,在特定条件下,它可以通过断裂DNA抑制艾滋病毒的繁殖.下列有关叙述中,正确的是( )
A.14C与12C的性质完全不同
B.14C与14N含有的中子数相同
C.14C60和12C60是碳元素的同素异形体
D.14C与12C、13C互为同位素难度: 中等查看答案及解析
-
若NA代表阿伏加德罗常数,则下列叙述中,正确的是( )
A.一定条件下,足量铜与200g 98%的浓硫酸充分反应,转移电子数目为2NA
B.16 g氧气和臭氧的混合物中含有的氧原子数为NA
C.1L 0.5 mol•L-1 Na2CO3溶液中含有的CO数为0.5NA
D.78g Na2O2中所含阴离子的数目是2NA难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.硅的化学性质不活泼,在自然界中可以以游离态存在
B.Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应
C.工业上制备镁是用电解熔融的MgO来完成的
D.SO2通入新制氯水中,氯水退色是因为SO2具有漂白性难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成
B.离子化合物中一定有金属元素
C.蛋白质溶液、淀粉溶液和葡萄糖溶液都是胶体
D.共价化合物中各原子都一定满足最外层8电子稳定结构难度: 中等查看答案及解析
-
下列实验操作中,可以达到预定目的是( )
A.用渗析的方法可以除去氢氧化铁胶体中的少量氯化钠
B.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3
C.通过灼热的镁粉,可以除去N2中的少量O2
D.用溶解、过滤的方法可分离Na2SO4和NaCl固体混合物难度: 中等查看答案及解析
-
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )
A.阴极自始至终只产生H2
B.电解过程中,溶液颜色呈现红色→紫色→蓝色的变化
C.电解过程中,Na+和SO42-的物质的量浓度保持不变
D.第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl难度: 中等查看答案及解析
-
下列各组离子可能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+
C.在c(H+)=1×10-13 mol•L-1的溶液中:Na+、S2-、SO32-、NO3-
D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-难度: 中等查看答案及解析
-
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中,正确的是( )
A.原子序数:A>B>C
B.原子半径:A>B>C
C.离子半径:A2->B2+>C-
D.原子最外层电子数:A>C>B难度: 中等查看答案及解析
-
表示下列变化的化学用语中,正确的是( )
A.碳酸氢钠溶液与少量澄清石灰水反应的离子方程式:HCO3-+Ca2++OH‑═CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:OH-+NH4+H2O+NH3↑
C.NaHCO3的水【解析】
HCO3-+H2O═H3O++CO32-
D.钢铁吸氧腐蚀的正极反应:4OH-→O2↑+2H2O+4e-难度: 中等查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.0.1 mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+)
C.0.1 mol•L-1的HCl溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c (OH-)+c(Cl-)
D.0.1 mol•L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
关于下列图示的说法中,正确的是( )

A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H大于0
D.图④装置可以用来除去SO2中的HCl难度: 中等查看答案及解析
-
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列叙述中,正确的是( )
A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2═2FeCl3+4FeI3
B.每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-
C.FeCl3溶液能使淀粉-KI试纸变蓝
D.I2是ⅦA族元素单质,具有较强的氧化性,可以将Co2+氧化成Co2O3难度: 中等查看答案及解析
-
已知,常温下,KSP (AgCl)=1.8×10-10 mol2•L-2,KSP(AgI)=8.3×10-17 mol2•L-2,下列叙述中,正确的是( )
A.常温下,AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001 mol•L-1的AgNO3 溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)难度: 中等查看答案及解析