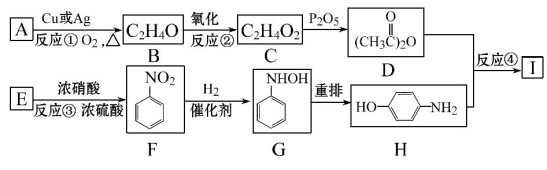
-
下列实验的失败原因可能是因为缺少必要的实验步骤造成的是( )
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银液出现褐色沉淀
④做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜
A.①④⑤ B.①③④⑤ C.③④⑤ D.④⑤
难度: 中等查看答案及解析
-
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是( )
A.大力研发新型有机溶剂替代水作为萃取剂
B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
D.使用甲醇、乙醇混合型汽油可以减少对大气的污染
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间任何一种反应物的减小或任何一种生成物的增加
B.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L
C.对于任何化学反应来说,反应速率越大,反应现象就越明显
D.根据化学反应速率的大小可以知道化学反应进行的快慢
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.在100 ℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g) ===H2O(l)的ΔH=+40.69 kJ·mol-1
B.已知CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则CH4的燃烧热ΔH=-890.3 kJ
C.H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ·mol-1其他相关数据如下表:

则表中a为230
D.已知S(g)+O2(g)===SO2(s)ΔH1,S(g)+O2(g)===SO2(g)ΔH2,则ΔH2<ΔH1
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.加入少量的C(s)粉 B.将C(s)粉碎成细小粉末
C.体积可变,充入氩气 D.保持体积不变,充入氢气
难度: 中等查看答案及解析
-
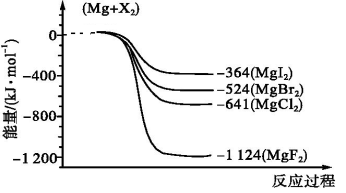
根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)
2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断中正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.物质的量相同时,反应②的反应物总能量比反应①的反应物总能量低
难度: 中等查看答案及解析
-
下列说法中正确的说法有几个 ( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
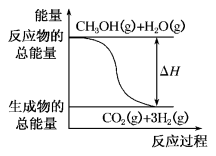
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+
O2(g)===CO2(g)+2H2(g) ΔH >-192.9 kJ·mol-1
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸; ②浓H2SO4;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是 ( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1=△H3>△H2 D.△H1>△H3>△H2
难度: 简单查看答案及解析
-
下列书写或说法正确的是 ( )
A.聚丙烯的链节是—CH2—CH2—CH2—
B.向苯酚溶液中滴加Na2CO3溶液:
C.2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA
D.苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响
难度: 简单查看答案及解析
-
尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:

下列说法错误的是 ( )
A.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
B.1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D.1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3
难度: 困难查看答案及解析
-
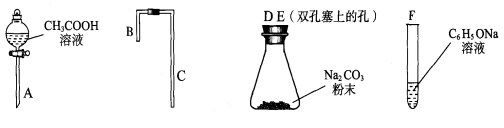
下列装置或操作能达到实验目的的是( )
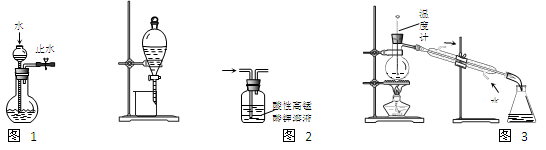
A. 图1所示装置可检查装置气密性
B.图2所示装置可从碘的CCl4溶液中分离出碘
C.图3所示装置可除去甲烷中乙烯
D.图4所示装置可分离甲苯与乙醇
难度: 中等查看答案及解析
-
由
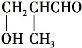 转变成
转变成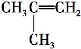 需经过下列合成途径的顺序是 ( )
需经过下列合成途径的顺序是 ( )A.消去→加成→消去 B.加成→消去→脱水
C.加成→消去→加成 D.取代→消去→加成
难度: 中等查看答案及解析
-
已知乙烯醇(CH2=CHOH)不稳定,可自动转化为乙醛;二元醇可脱水生成环状化合物,现有1 mol乙二醇在一定条件下脱去1 mol H2O,所得产物的结构简式有下列几种,其中不可能的是 ( )
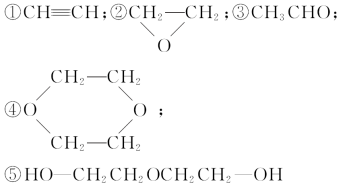
A.只有① B.只有①④ C.只有①④⑤ D.①②③④⑤
难度: 困难查看答案及解析
-
一次性使用的聚苯乙烯(
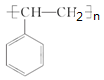 )材料易造成“白色污染”,其替代物(
)材料易造成“白色污染”,其替代物()是由乳酸(
)聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法正确的是 ( )
A.聚苯乙烯的单体为
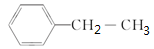
B.聚苯乙烯与聚乳酸的聚合方式相似
C.聚苯乙烯和聚乳酸均为纯净物
D.乳酸可发生消去反应
难度: 中等查看答案及解析
-
下图表示在催化剂作用下X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基)。

则下列有关叙述不正确的是 ( )
A.反应①属于加成反应
B.1 mol W完全加成需要4mol H2
C.X的核磁共振氢谱有四个峰
D.X、Y、W、Z都能与NaOH溶液反应
难度: 困难查看答案及解析
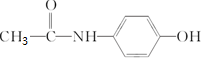 )是最常用的非甾体消炎解热镇痛药,可用如下方法合成:
)是最常用的非甾体消炎解热镇痛药,可用如下方法合成: