-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物休内的叶绿素非常相似。下列说法中不正确的是
A.“钴酞菁”分子所形成的分散系不具有丁达尔效应
B.“钴酞菁”分子能透过滤纸
C.此项工作可以用来改变分子的某些物理性质
D.此项工作可广泛应用于光电器件、生物技术等方面
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是 ( )
A.Al2(SO4)3==2Al3++3SO42—
B.Ca(NO3)2==Ca2++2(NO3)2-
C.Ba(OH)2==Ba2++OH2—
D.Na2CO3==Na2++CO32—
难度: 中等查看答案及解析
-
下列实验操作的描述中,正确的是 ( )
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.1 mol的CH4质量为16g/mol B.3.01×1023个CO2分子的质量约为22g
C.H2O的摩尔质量为18g D.标准状况下,1 mol任何物质体积均为22.4L
难度: 中等查看答案及解析
-
食盐分散到酒精中形成直径在1nm~100nm之间的超细粒子,这样的分散系是( )
A.悬浊液 B.溶液 C.胶体 D.乳浊液
难度: 简单查看答案及解析
-
人们常根据物质各种特点对物质进行分类.下列分类中,前者包含后者的是( )
A.氧化物、化合物 B.溶液、分散系
C.含氧酸、酸 D.化合物、电解质
难度: 中等查看答案及解析
-
下列物质属于电解质的是 ( )
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖
⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3
A.②⑤⑦ B.①②⑦ C.①⑥⑦ D.①⑤⑥
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,正确的是 ( )
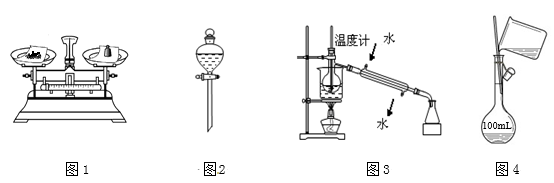
A. 用图1所示方法称量固体氯化钠
B. 用图2装置分离碘的四氯化碳溶液
C. 用图3所示装置和方法进行石油分馏
D. 用图4装置配制150 mL稀盐酸
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Mg2+、Cl-、SO42-
B.滴加石蕊试液显红色的溶液:K+、Al3+、Cl-、NO3-
C.含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+
难度: 中等查看答案及解析
-
实验室欲配制6.00 mol·L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸 ②150 mL 3.00 mol·L-1的硫酸 ③足量的18.00 mol·L-1的浓H2SO4。配制要求:①、②两种硫酸全部用完,不足部分由③补充。选用容量瓶的规格是( )
A.100 mL B.250 mL C.500 mL D.1000 mL
难度: 困难查看答案及解析
-
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B. 密度 C.分子数 D. 质子数
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.石灰石溶于稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
C.氧化镁与稀硫酸:MgO+2H+=Mg2++H2O
D.常温下,将铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
难度: 中等查看答案及解析
-
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
难度: 困难查看答案及解析
-
下列实验操作完全正确的是 ( )
编号
实验
操作
A
用浓硫酸配制一定浓度的稀硫酸
准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中。
B
除去BaSO4中的少量BaCO3
加入足量盐酸,充分反应后,过滤、洗涤、干燥
C
量取盐酸溶液
用25 mL量筒量取4.0 mol/L的盐酸5.62 mL
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
难度: 中等查看答案及解析
-
在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是 ( )
A.11.2 g B.25.2 g C.16.8 g D.33.6 g
难度: 困难查看答案及解析