-
化学与生活、生产密切相关,下列有关说法错误的是( )
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B. “一带一路” 是现代“ 丝绸之路”,丝绸的主要成分是纤维素
C. “从沙滩到用户”,计算机芯片的材料是晶体硅
D. 硝石“外观如雷雪,强烧之,紫青烟起”,该过程中利用了焰色反应
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24 L三氯甲烷中所含分子数为NA
B. 1mol H2与1molI2(g)于密闭容器中反应,生成的H-I键数为2NA
C. 常温下,0.1mol Fe投入到足量浓硫酸中反应,转移的电子数为0.3NA
D. 8.8g乙酸乙酯和乙醛(CH3CHO)的混合物中含有的C原子数为0.4NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
C. 元素Y的简单气态氢化物的热稳定性比Z的强
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 中等查看答案及解析
-
关于有机物a(
 )、b<(
)、b<( )、c(
)、c( )的说法错误的是( )
)的说法错误的是( )A. a是b的同分异构体 B. b不是c的同系物
C. c分子中的所有原子不可能在同一平面上 D. a、c均能与溴水反应,b可萃取溴水中的溴
难度: 中等查看答案及解析
-
用如图装置进行实验,下列预期实验现象及相应结论均正确的是( )
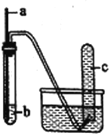
a
b
预期实验现象
结论
A
铜丝
浓硝酸
试管c中有大量红
棕色气体
浓硝酸有强氧化性
B
木条
18.4mol·L-1硫酸
木条下端变黑
浓硫酸有酸性和氧化性
C
生铁
NaCl溶液
导管处发生水倒吸
生铁发生吸氧腐蚀
D
铁丝
含少量HCl的H2O2
溶液
试管c中有大量无色气体
该反应中铁作催化剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH容液,其工作原理如图所示。

下列说法正确的是( )
A. 电极f为阳极,电极e上H+ 发生还原反应
B. 电极e的电极反应式为4OH--4e-=2H2O+O2↑
C. d处流进粗KOH溶液,g处流出纯KOH溶液
D. b处每产生11.2L气体,必有1molK+ 穿过阳离子交换膜
难度: 中等查看答案及解析
-
常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )
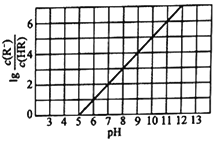
A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
难度: 困难查看答案及解析


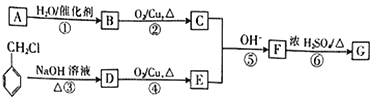
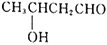 。
。