-
《中华人民共和国食品安全法》2009年6月1日起实施。下列做法符合食品安全的是
A.将塑化剂加入饮料来稳定饮料体系
B.在食用盐中添加适量的碘酸钾
C.将瘦肉精加入猪饲料或羊饲料中增加瘦肉成分
D.加入柠檬黄色素做成玉米面馒头以提高食欲
难度: 简单查看答案及解析
-
据报道,月球上存在大量3He,以下有关3He的说法正确的是
A.3He比4He少一个中子 B. 3He是4He的同分异构体
C.3He比4He少一个质子 D.3He原子核内有3个质子
难度: 简单查看答案及解析
-
X、Y两种元素在同一周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:Y对应的酸性弱于X对应的酸性
D.气态氢化物的稳定性:HmY小于HnX
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和BCl3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
难度: 简单查看答案及解析
-
下列叙述正确的是
A.分子晶体中只存在分子间作用力,不含有其他化学键
B.在单质的晶体中一定不存在离子键
C.任何晶体中,若含有阳离子也一定含有阴离子
D.金属在常温下都以晶体形式存在
难度: 简单查看答案及解析
-
关于电解质溶液的说法正确的是
A.中和等体积,等pH的盐酸和醋酸溶液,盐酸所需氧氧化钠小于醋酸
B.强电解质溶液的导电能力一定比弱电质溶液强
C.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的一半
D.如果盐酸的浓度是醋酸溶液的二倍,则盐酸的H+浓度也是醋酸H+浓度的二倍
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,VLCHCl3含有的碳原子数为VNA/22.4
B.1mol二氧化硅晶体中含有Si—O键的数目为4NA
C.标准状况下22.4L氩气,含氩原子的数目为2NA
D.干冰晶胞中含有C=O键数目为4NA
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中不正确的是
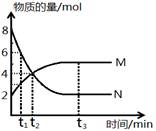
A.反应的化学方程式为:2M
N
B.t3时,正逆反应速率相等
C.t2时,N的消耗速率大于N的生成速率
D.t1时,N的浓度是M浓度的2倍
难度: 简单查看答案及解析
-
在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 简单查看答案及解析
-
在下列给定条件下的溶液中,一定能大量共存的离子组是
A.无色溶液中:Ca2+、H+、Cl-、HCO3-、MnO4-
B.能使pH试纸呈红色的溶液中:Na+、NH4+、NO3-、I-
C.FeCl3溶液中:K+、Na+、SO42-、AlO2-
D.
的溶液:Na+、K+、SiO32-、NO3-
难度: 简单查看答案及解析
-
已知298K时,2SO2(g) + O2(g)
2SO3(g);△H =—Q1 kJ/mol,在相同温度下,向密闭容器中通入4molSO2和1molO2,达到平衡时放出热量Q2 kJ,则下列关系式正确的是
A. Q2 = 2Q1 B. Q2<2Q1 C. Q2=Q1 D.Q2<Q1
难度: 简单查看答案及解析
-
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一生铁块,放置一段时间。下列有关描述错误的是
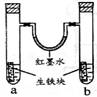
A.生铁块中的碳是原电池的正极
B.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
C.两试管中相同的电极反应式是:Fe-2e-= Fe2+
D.红墨水柱两边的液面变为左低右高
难度: 简单查看答案及解析
-
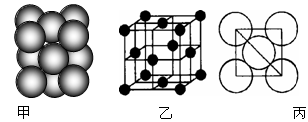
下列关于固体物质:Cu、Si和Ne的说法中正确的是
A.Cu、Si和Ne三种晶体中,熔点最低的是Ne
B.晶体Mg属于金属晶体,其中Mg原子的堆积方式是面心立方最密堆积
C.1mol晶体Si中,含有4molSi—Si键
D.Si和Ne都是非金属元素,所以它们的晶体类型是相同的
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物
难度: 简单查看答案及解析
-
3—甲基戊烷的一氯代产物有(不考虑立体异构)
A.3种 B.5种 C.4种 D.6种
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
难度: 简单查看答案及解析
-
下列有关晶体的叙述中错误的是
A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子
B.氯化钠晶体中每个Na+周围紧邻的有6个Cl—
C.CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
难度: 简单查看答案及解析
-
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是

A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
难度: 简单查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比SnH4分子稳定性大
Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
难度: 简单查看答案及解析