-
下列变化过程,属于放热反应的是
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧
A.②③④⑤ B.②③④ C.②⑤ D.①③⑤
难度: 简单查看答案及解析
-
下列关于热化学反应的描述,正确的是
A.HCl和NaOH反应的中和热△H= -57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
已知H+(ag)+OH-(ag)=H2O(l) △H= -57.3kJ•mol-1。现有以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l);
③HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l);其中反应热为△H=-57.3kJ•mol-1的是
A.①和③ B.③ C.④ D.以上都不对
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.0.1 mol•L-1HCl和0.1 mol•L-1H2SO4与2mol•L-1NaOH溶液反应,其反应速率相同
B.大理石块与大理石粉分别同0.1 mol/L盐酸反应,其反应速率相同
C.Mg、Al在相同条件下分别与0.1 mol/L盐酸反应,其反应速率相同
D.0.1 mol/L HCl和0.1 mol/L HNO3与相同形状和大小的大理石反应,其反应速率相同
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9kJ•mol-1
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2 O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1
难度: 困难查看答案及解析
-
反应A+B=2C,在反应过程中,断裂1molA中的化学键消耗的能量为Q1kJ,断裂1molB中的化学键消耗的能量为Q2kJ,形成1molC中的化学键释放的能量为Q3kJ;1molA所含化学能为E1kJ,1molB所含化学能为E2kJ,1molC所含化学能为E3kJ,下列说法中一定正确的是
A.若E1+E2>E3,则反应为放热反应
B.若Q1+Q2>Q3,则反应为放热反应
C.若Q1+Q2<Q3,则反应为放热反应
D.若E1+E2>E3,则反应为吸热反应
难度: 中等查看答案及解析
-
对于反应N2+O2
2NO,在密闭容器中进行,下列条件能使该反应的逆反应速率加快的是
A.缩小体积使压强增大
B.压强不变充入He使体积增大
C.体积不变充入He使压强增大
D.压强不变充入N2使体积增大
难度: 中等查看答案及解析
-
在恒温恒压、不做功时,反应A+B=C+D在下列哪种情况下,一定能自发进行
A.△H<0,△S<0 B.△H>0,△S<0 C.△H<0,△S>0 D.△H>0,△S>0
难度: 中等查看答案及解析
-
10 mol浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气的生成的是
A.NaHCO3 B.CH3COONa C.CuSO4 D.Na2CO3
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v逆(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
一定温度下,浓度均为1 mol•L-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)=0.58 mol•L-1,c(B2)=0.16 mol•L-1,c(C)=0.84mol•L-1,则该反应的正确表达式为:
A.2A2+B2
2A2B B.A2+B2
2AB
C.A2+B2
A2B2 D.A2+2B2
2AB2
难度: 中等查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g)经过一段时间后,SO3的浓度增加了0.4 mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•(Ls)-1,则这段时间为
A. 5s B.2.5s C.0.1s D.10s
难度: 简单查看答案及解析
-
反应2A(g)
2B(g)+E (g) △H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小E的浓度 D.降温
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g)
Z(g)+W(s) △H>0,下列叙述正确的是
A.当容器中气体密度不变时,反应达到平衡
B.加入少量W,逆反应速率增大
C.升高温度,Y的百分含量增加
D.平衡后加入X,上述反应的△H增大
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C (g) △H<0,下列各图中正确的是
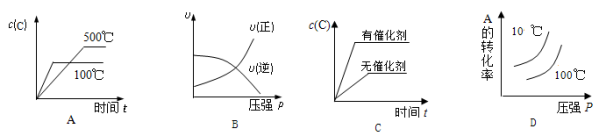
难度: 中等查看答案及解析
-
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列条件错误的是
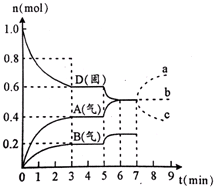
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L·min)
B.根据图该反应的平衡常数表达式为k=
C.若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合b曲线
难度: 困难查看答案及解析
-
可逆反应A(g)+B
C (g)+D达到平衡时,下列说法不正确的是
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B.增大压强,平衡不移动,说明B、D必是气体
C.升高温度,C的百分含量减小,说明正反应是放热反应
D.若B是气体,增大A的浓度会使B的转化率增大
难度: 中等查看答案及解析
