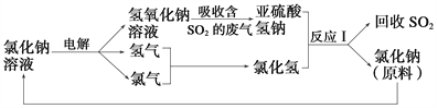
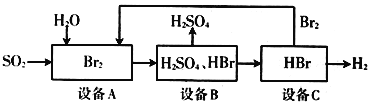
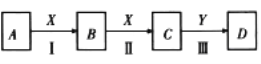
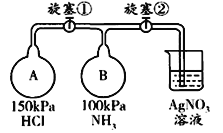
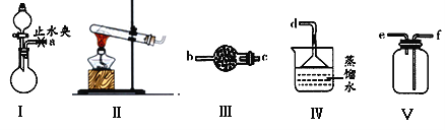-
下列有关硫、氮单质及其化合物的叙述正确的是( )
A. SO2、NO2二种气体都能与水反应生成酸,它们都是酸性氧化物
B. 硫粉在过量的纯氧中燃烧可以生成SO3
C. 往某溶液中加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+
D. 铜片与稀盐酸不反应,向溶液中加入固体KNO3后,铜片质量不变
难度: 中等查看答案及解析
-
以下关于铜跟浓、稀HNO3反应的说法中错误的是( )
A. 生成等物质的量的气体,浓HNO3与铜的反应中转移的电子数多
B. Cu与浓HNO3反应比与稀HNO3反应剧烈
C. 两反应中被还原的HNO3的物质的量都等于产生气体的物质的量
D. 生成等量Cu(NO3)2,消耗浓HNO3的量多
难度: 简单查看答案及解析
-
下列现象的产生与氮氧化物无关的是( )
A. 臭氧层空洞 B. 温室效应 C. 光化学烟雾 D. 酸雨
难度: 简单查看答案及解析
-
下列属于氮的固定的是( )
A. 植物从土壤中吸收含氮养料;
B. 豆科植物根瘤菌将含氮化合物转变为植物蛋白质;
C. 将氨转变成硝酸及其它氮的化合物;
D. 将空气中的氮气转变为含氮化合物。
难度: 中等查看答案及解析
-
实验室里需保存在棕色试剂瓶里的试剂是( )
A. Na2SO3 B. FeSO4溶液 C. 浓硝酸 D. 浓硫酸
难度: 简单查看答案及解析
-
下列有关硫及其化合物的叙述正确的是( )
A. 硫单质是一种淡黄色易溶于水的固体
B. SO2具有漂白性,可用于食品的漂白
C. 用作“钡餐”的物质主要成分是硫酸钡
D. 可用澄清石灰水鉴别SO2和CO2
难度: 简单查看答案及解析
-
下列反应中能产生气体,但不是氧化还原反应的是( )
A. 浓盐酸与二氧化锰共热 B. 稀硫酸与硫化亚铁固体反应
C. 硝酸银与稀盐酸反应 D. 过氧化钠与水反应
难度: 简单查看答案及解析
-
下列反应中,硫元素表现出还原性的是( )
A. 稀硫酸与锌粒反应 B. 亚硫酸与氧气反应
C. 浓硫酸与炭反应 D. Na2SO3固体与浓H2SO4 反应
难度: 简单查看答案及解析
-
按右下图进行实验,试管内充满NO,然后间歇而缓慢地通入一定体积的O2,下面有关实验最终状态的描绘,不正确的是
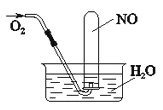
A. 若最终有气体剩余,气体可能是NO
B. 若最终有气体剩余,气体呈红棕色
C. 试管内溶液为稀硝酸
D. 试管内液面高度肯定会上升
难度: 中等查看答案及解析
-
下列各组物质中,常温下能起反应并产生氢气的是( )
A. 铜与浓硝酸 B. 铜与浓硫酸 C. 铁与稀硝酸 D. 铝与稀硫酸
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 铵态氮肥不能与碱性肥料混合施用
B. 液氨可用作致冷剂
C. O2、H2S、SO2、H2均能用浓硫酸干燥,且常温能共存
D. 过量的SO2可使紫色石蕊溶液变红,但不褪色
难度: 简单查看答案及解析
-
发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量红棕色的气体,产生红棕色的气体的原因是( )
A. NO遇空气生成NO2 B. 高温下N2遇空气生成NO2
C. CO2与N2反应生成CO和NO2 D. NO和H2O反应生成H2和NO2
难度: 简单查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与其浓度和反应温度有关。下列各组物质反应产物与其浓度有关的是( )
①Cu与HNO3溶液 ②Na与O2 ③Zn 与H2SO4 溶液 ④Fe 与盐酸
A. ①③ B. ③④ C. ①② D. ①③④
难度: 中等查看答案及解析
-
下列变化需加入氧化剂才能实现的是( )
A. H2S→SO2 B. SO2→SO32- C. HNO3→NO2 D. S→Cu2S
难度: 简单查看答案及解析
-
在溶液中能大量共存的一组离子是( )
A. K+、H+、SO32-、S2- B. NH4+、K+、OH-、Cl-
C. H+、K+、MnO4-、SO42- D. Fe3+、Na+、S2-、NO3-
难度: 简单查看答案及解析
-
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入或加入另一种物质仍无沉淀产生,则通入或加入的物质不可能是( )
A. 氨水 B. CO2 C. 过氧化氢溶液 D. SO3
难度: 简单查看答案及解析
-
下列除杂的操作方法,正确的是( )
A. CO2中混有少量SO2:通过装有NaOH溶液的洗气瓶
B. NO中混有少量NO2气体:用水洗涤后再干燥
C. 食盐中混有少量NH4Cl:加过量NaOH溶液后加热蒸干
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A. Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
B. AlCl3溶液中加过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. 铁片放入稀盐酸中:2Fe+6H+===2Fe3++3H2↑
D. Fe与过量稀HNO3反应:3Fe+8H++2NO3- =3Fe2++4H2O+2NO↑
难度: 简单查看答案及解析
-
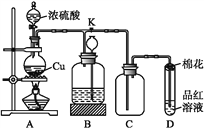
下列有关实验装置的说法正确的是( )
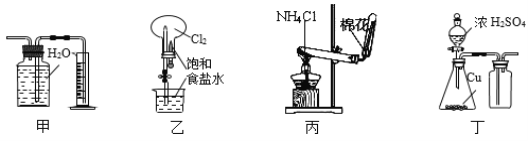
A. 用图甲装置收集并测量NO的体积
B. 用图乙装置可以完成“喷泉”实验
C. 用图丙装置实验室可以制氨气
D. 用图丁装置制取并收集SO2
难度: 中等查看答案及解析
-
为了检验SO42-,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
A. 方案甲:试液
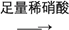 无沉淀
无沉淀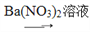 白色沉淀
白色沉淀B. 方案乙:试液
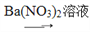 白色沉淀
白色沉淀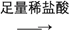 沉淀不溶解
沉淀不溶解C. 方案丙:试液
白色沉淀
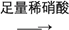 沉淀不溶解
沉淀不溶解D. 方案丁:试液
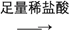 无沉淀(也无气泡)
无沉淀(也无气泡)白色沉淀
难度: 中等查看答案及解析