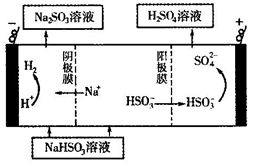
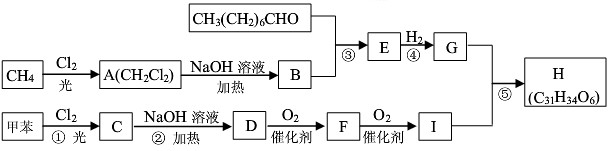
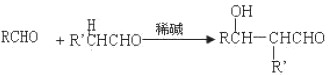
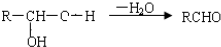-
下列关于有机化合物的结构、性质的叙述正确的是
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“一OH”
难度: 简单查看答案及解析
-
某有机物分子式为C4H8,据此推侧其结构和性质不可能的是
A.它与乙烯可能是同系物
B.一氯代物只有一种
C.分子结构中甲基的数目可能是0、1、2
D.等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO-
B.滴入酚酞显红色的溶液中: Na+、Al3+、CO32-、AlO2-
C.含有Fe3+的溶液中: Na+、Al3+、Cl-、SCN-
D.pH=1的溶液中: Fe2+、Cl-、NO3-、K+
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A.在0.1mol/L Na2C2O4中:2c(Na+)=c(C2O42- )+c(HC2O4-)+c(H2C2O4)
B.浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c〔HCO3-)
C.向10mL pH= l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)> c(Na+)> c(OH-)>c(H+)
D.0.2mol/L NaHCO3与0.1mol/L KOH溶液等体积混合:c(Na+)=2c(CO32-)+ c〔HCO3-)+ c(H2CO3)
难度: 困难查看答案及解析
-
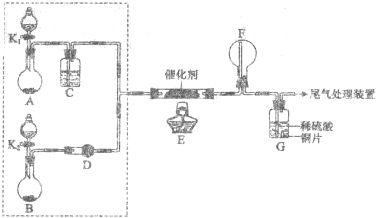
恒温下,在容积为2升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:H2 (g) +I2(g)
2HI(g) △H=-Q kJ/mol,实验时有关数据如表:

下列判断正确的
A.甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L·min)
B.平衡时,放出的热量: Q1=4.0×10-3Q kJ
C.平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高
D.该温度下,该反应的平衡常数K=0.25
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价+6
B.简单离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的稳定性:Q>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论不一致的是
选项
实验操作
实验目的或结论
A
将Al2(SO4)3、NaOH溶液相互滴加
鉴别Al2(SO4)3、NaOH溶液
B
向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色
该溶液中一定含有Fe2+
C
向NaHS溶液中滴入酚酞,溶液变红色
HS-水解程度大于电离程度
D
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀
蛋白质均发生了变性
难度: 中等查看答案及解析