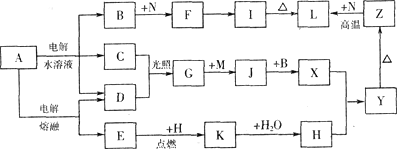
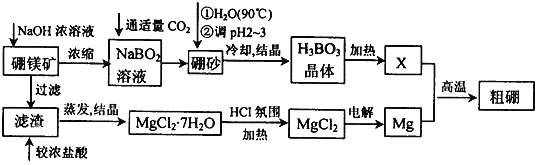
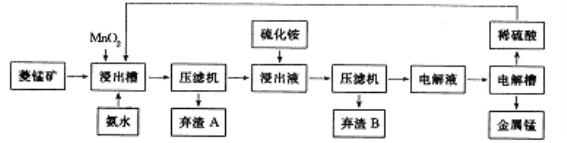
-
化学与人类生活密切相关,下列解决问题的方法不可行的是( )
A. 为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B. 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C. 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
D. 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
难度: 中等查看答案及解析
-
下列有关环境保护与绿色化学的叙述不正确的是( )
A. 形成酸雨的主要物质是硫的氧化物和氮的氧化物
B. 大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C. 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D. 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
难度: 简单查看答案及解析
-
下列各组离子能在指定溶液中可以大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、H2PO4-、PO43-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变红的溶液中:Fe3+、MnO4-、NO3-、Na+、SO42-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A. ②④⑤ B. ①③⑥ C. ①②⑤ D. ②④⑥
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 在100 mL 1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O===2Fe2++SO
+4H+
B. 在100 mL 2 mol·L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2===4Fe3++3I2+10Cl-
C. 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO
+4OH-===Mg(OH)2↓+2CO
+2H2O
D. 向NH4Al(SO4)2溶液中加入Ba(OH)2恰好使SO
反应完全2Ba2++4OH-+Al3++2SO
=2BaSO4↓+AlO
+2H2O
难度: 简单查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法正确的是( )
A. 1L lmol·L-1NaClO溶液中含有阴离子的数目小于NA
B. Na2O2与足量的CO2反应生成1molO2,转移电子数目为2NA
C. 两份2.7g 铝分別与100mL浓度为2 mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA
D. 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝。
原溶液中无NH4+
B
室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。
Ksp(BaSO4)<Ksp(CaSO4)
C
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。
Fe3+的氧化性比I2的强
D
室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。
HSO3-结合H+的能力比
SO32-的强
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
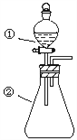
选项
①中物质
②中物质
预测②中的现象
A
草酸溶液
酸性高锰酸钾溶液
溶液逐渐褪色
B
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
C
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
D
氯化铝溶液
浓氢氧化钠溶液
立即产生大量白色沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如下图所示,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质分别是( )

A. CO2和Na2CO3溶液 B. Cl2和NaHCO3溶液
C. SO2和浓H2SO4 D. SO2和NaHCO3溶液
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH-+ 18H2O = 3NH3+ 8[Al(OH)4]-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中一定不含Al3+
B. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
难度: 简单查看答案及解析
-
向10 mL含等浓度的I-和Cl-的溶液中逐滴加入0.1 mol·L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。下列说法不正确的是( )
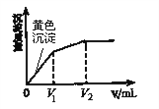
A. 该实验可以证明AgI比AgCl更难溶
B. V1= V2-V1
C. 向最终的沉淀中加入Na2S溶液,沉淀变成黑色
D. 加入V2 mL AgNO3溶液后,溶液中不含I-
难度: 简单查看答案及解析
-
实验室用
还原
制备金属
的装置如图所示(
粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )

A. ①、②、③中依次盛装
溶液、浓
、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞
,再停止加热
D. 装置
(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )
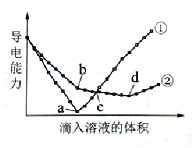
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
难度: 极难查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:
其中第①步存在平衡:2CrO42-(黄色)+2H+
Cr2O72-(橙色)+H2O
下列说法正确的是( )
A. 反应②中还原1mol Cr2O72—,需要6 mol的Fe2+
B. 改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化
C. 若2v (Cr2O72-) =v (CrO42-),说明反应①达平衡状态
D. FeSO4溶液呈酸性的原因是Fe2++ 2H2O
Fe(OH) 2↓+ 2H+
难度: 中等查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①
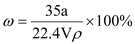 ②
②③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
难度: 中等查看答案及解析
-
向27.2g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性.金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A. Cu与Cu2O的物质的量之比为2:1
B. 硝酸的物质的量浓度为2.4mol/L
C. 产生的NO在标准状况下的体枳为4.48L
D. Cu、Cu2O与硝酸反应后剩余HNO3为lmol
难度: 困难查看答案及解析