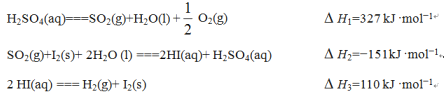-
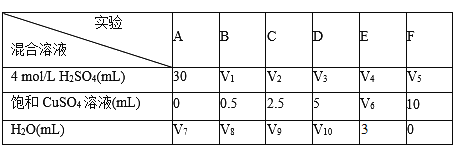
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2
2(t-BuNO) ΔH=+40.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列图象合理的是( )
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
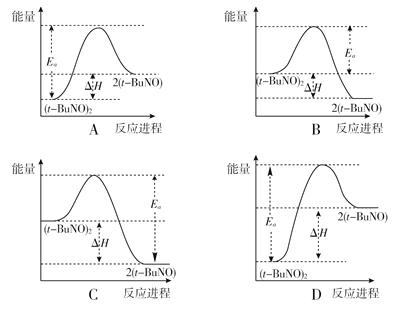
一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为20kJ·mol-1
C. b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=+116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11:1:2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B. 向Cr2O72- + H2O
2CrO42-+ 2H+ 的平衡体系中滴加10~20滴6mol/LNaOH溶液颜色由橙色变黄色
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ·mol-1
D. 已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应
 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HI(aq)=NaI(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C. S(s)+
O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
D. 2NO2=O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
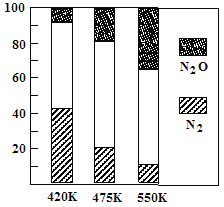
研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
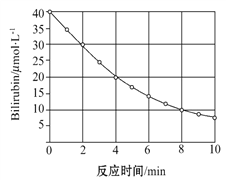
A. 2.5 μmol·L-1·min-1和2.0 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
难度: 中等查看答案及解析
-
下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A. 2 个 B. 3 个 C. 4 个 D. 5个
难度: 中等查看答案及解析
-
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
难度: 简单查看答案及解析
-
在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)
N2O4(g) △H<0]:
容器
物质
起始浓度/(mol
L-1)
平衡浓度/(mol
L-1)
Ⅰ
N2O4
0.100
0.040
NO2
0
0.120
Ⅱ
N2O4
0
0.0142
NO2
0.100
0.0716
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
难度: 中等查看答案及解析
-
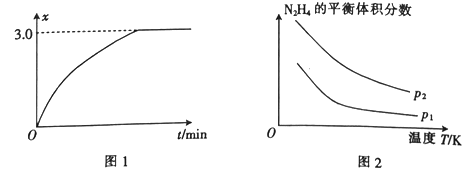
如下图所示,平衡混合物中X的质量分数(w)在不同的压强下,随温度(T)变化的情况,在下述的哪个平衡体系中,X可以代表用横线标明的物质(反应中各物质均为气体)( )。
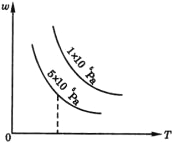
A. N2+3H2
2NH3 △H<0
B. H2+I2
2HI △H<0
C. 2SO3
2SO2+O2 △H>0
D. 4NH3+5O2
4NO+6H2O △H<0
难度: 困难查看答案及解析
-
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
2C(g) ΔH<0,某时刻达到平衡后,在
时刻改变某一条件,其反应过程如图所示。下列说法正确的是( )
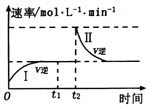
A.
B. I、Ⅱ两过程达到平衡时,A的体积分数I>II
C.
时刻改变的条件是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数I<II
难度: 中等查看答案及解析
-
一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)
COS(g)+H2O(g)
实验
温度/K
起始物质的量/mol
平衡物质的量/mol
平衡常数
CO2
H2S
H2O
I
607
0.11
0.41
0.01
II
607
0.22
0.82
III
620
0.1
0.4
6.74×10-3
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
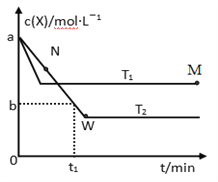
A. M点的正反应速率v正大于N点的逆反应速率v逆
B. T2下,在0 ~ t1时间内,v(Y)=
mol·L-1·min-1
C. 该反应进行到M点放出的热量大于进行到W点放出的热量
D. M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B. 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
C. CH3COOH 溶液加水稀释后,溶液中
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解向左移动,溶液的pH 增大
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是
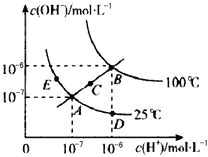
A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )
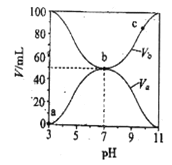
A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,
 随温度升高而减小
随温度升高而减小D. a→c过程中水的电离程度始终增大
难度: 困难查看答案及解析
-
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
难度: 困难查看答案及解析
-
若用AG来表示溶液的酸度,其表达式为:AG=lg[
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
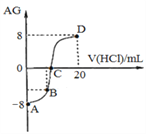
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−)
难度: 困难查看答案及解析
-
改变0.1
二元弱酸
溶液的pH,溶液中的
、
、
的物质的量分数
随pH的变化如图所示[已知
]。下列叙述错误的是( )
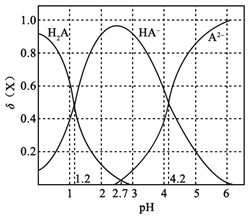
A. pH=1.2时,
B.
C. pH=2.7时,
D. pH=4.2时,
难度: 困难查看答案及解析