-
下列属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠溶于水
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华.
A.①④ B.②④ C.③⑤ D.④⑥
难度: 中等查看答案及解析
-
电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH﹣﹣2e﹣→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e﹣→2Ag+2OH﹣,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag。下列说法正确的是( )
A.锌是正极,氧化银是负极
B.锌发生还原反应,氧化银发生氧化反应
C.溶液中OH﹣向正极移动,K+、H+向负极移动
D.随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.CO2的电子式:
B.质量数为37的氯原子:
Cl
C.NH4Cl的电子式:
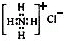 D.原子核内有10个中子的氧原子:
D.原子核内有10个中子的氧原子:难度: 中等查看答案及解析
-
下列物质中,各原子的最外层电子满足8电子稳定结构的分子是( )
A. CO2 B.N2O5 C.PCl5 D.NaCl
难度: 中等查看答案及解析
-
下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )
A.食盐和金属钠的熔化 B.氯化铵和单质硫的熔化
C.碘和干冰的升华 D.金刚石和石灰石的熔化
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
D.在周期表里,主族元素所在的族序数等于原子核外电子数
难度: 中等查看答案及解析
-
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
元素
X
Y
Z
W
原子半径(nm)
0.102
0.130
0.073
0.071
最高正价或最低负价
+6
+2
﹣2
﹣1,W无正价
A.HW水溶液可以保存在玻璃瓶中
B.X的单质与Z的单质反应生成XZ3
C.Z的最高正价为+6
D.原子序数X>Y>W>Z
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
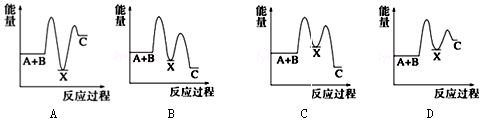
难度: 中等查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )

A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
难度: 中等查看答案及解析
-
在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(N2)=0.1mol•L﹣1•s﹣1 B.v(H2)=0.1mol•L﹣1•min﹣1
C.v(NH3)=0.15mol•L﹣1•min﹣1 D.v(H2)=0.3mol•L﹣1•min﹣1
难度: 中等查看答案及解析
-
下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.②⑤⑦ B.②⑥⑦ C.②④⑤⑥⑦ D.②④⑥
难度: 中等查看答案及解析
-
四种短周期元素的离子aXm+、bYn+、cZn﹣、dRm﹣,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )
①a﹣b=n﹣m ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm﹣>Zn﹣ ⑥X一定可与冷水反应.
A.只有②正确 B.①②③④正确
C.①②③⑥正确 D.②③⑤正确
难度: 中等查看答案及解析
-
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
A.2Na+2H2O=2NaOH+H2↑ B.2Na2O2+2CO2=2Na2CO3+O2
C.C12+H2O
HC1+HC1O D.Na2CO3+BaC12=BaCO3↓+2NaC1
难度: 中等查看答案及解析
-
下列关于化学键说法正确的是( )
A.构成单质分子的微粒中不一定含有化学键
B.只含有共价键的物质一定是共价化合物
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2 中既有共价键又有离子键
难度: 中等查看答案及解析
-
A、B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )
A.n﹣5 B.n+3 C.n+13 D.n﹣13
难度: 中等查看答案及解析
-
在 2L密闭容器中发生反应N2+3H2⇋2NH3,经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )
A.6s B.4s C.3s D.2s
难度: 中等查看答案及解析
-
甲、乙是元素周期表中同一周期的两种元素,甲位于ⅡA族,其原子序数为x,乙位于ⅢA族,则乙的原子序数可能是:
①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10
A.① B.②③ C.①②③ D.全部
难度: 中等查看答案及解析