-
乙醇作为燃料的优点是:
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种可再生能源 ④燃烧时放出大量热量
A.①②③ B. ①②④ C. ①③④ D. ②③④
难度: 简单查看答案及解析
-
下列溶液在常温下显酸性的是:
A.NaOH B.Na2CO3 C.NH4Cl D.NaCl
难度: 简单查看答案及解析
-
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是:
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
难度: 简单查看答案及解析
-
某温度下,在一体积不变的密闭容器中充入1molN2O4气体,达到平衡后,再充入1mol N2O4气体,下列说法中错误的是
A.平衡向生成NO2的方向移动 B.新平衡相对旧平衡,N2O4的转化率增大
C.N2O4的浓度增大 D.混合气体的颜色加深
难度: 简单查看答案及解析
-
已知450℃时,反应H2(g)+I2(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
难度: 简单查看答案及解析
-
下列关于自发过程的叙述中,正确的是( )
A.只有不需要任何条件就能够自动进行的过程才是自发过程
B.需要加热才能够进行的过程肯定不是自发过程
C.同一可逆反应在不同条件下都有自发的可能
D.非自发过程在任何条件下都不可能变为自发过程
难度: 简单查看答案及解析
-
下列各组离子,在溶液中能大量共存,加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
A.Ba2+、NO3-、NH4+、Cl- B.Ca2+、HCO3-、NH4+、AlO2-
C.K+、Ba2+、Cl-、HS O3- D.Mg2+、NH4+、SO42-、K+
难度: 简单查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
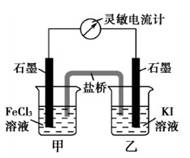
A.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.反应开始时,乙中石墨电极上发生氧化反应
难度: 简单查看答案及解析
-
反应C(s)+H2O(g) = CO(g)+H2(g)在一
可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半
③保持体积不变,充入N2 ④保持压强不变,充入N2
A.①④ B.①③ C.③ D.②③
难度: 简单查看答案及解析
-
已知热化学方程式:
,则对于热化学方程式:
,下列说法正确的是( )
A.热化学反应方程式中化学计量数表示分子个数
B.该反应的
C.
D.
难度: 简单查看答案及解析
-
如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是( )

A.乙池中d的电极反应为
B.a,c两极产生气体的物质的量相等
C.甲、乙两池中溶液pH均保持不变
D.乙池中发生的反应为
难度: 简单查看答案及解析
-
pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是( )
A.m=n B.m>n C.m<n D.无法判断
难度: 简单查看答案及解析
-
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
难度: 简单查看答案及解析
-
已知一种c(H+)=1×10-3 mol/L的酸和一种c(OH-)=1×10-3 mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
难度: 简单查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
气体体积/L
c(Y)/mol·L-1
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
下列说法正确的是( )
A.m>n B.温度不变,压强增大,Y的质量分数减少
C.Q<0 D.体积不变,温度升高,平衡向逆反应方向移动
难度: 简单查看答案及解析
-
用如下图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量。下列叙述不正确的是( )
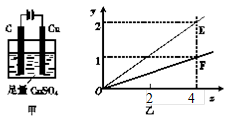
A.E表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.F表示反应生成H2SO4的物质的量
D.F表示反应生成O2的物质的量
难度: 简单查看答案及解析
-
某原电池的总反应方程式为2Fe3+ +Cu = 2Fe2+ + Cu2+,能实现该反应的原电池为
A
B
C
D
正极材料
Cu
石墨
Fe
Ag
负极材料
Fe
Cu
Cu
Cu
难度: 简单查看答案及解析
-
用石墨电极电解100mL 0.100mol/L CuSO4与0.200mol/L NaCl的混合溶液,设电解时产生的气体全部逸出。电解一段时间后,当阴极收集到224mL气体时,则另一极收集到气体的体积是(所有气体的体积均为标准状况下测定)
A.112mL B.224mL C.336mL D.448mL
难度: 简单查看答案及解析
-
用1L 10mol/L NaOH溶液吸收0.8molCO2,所得溶液中CO32–和HCO3–的物质的量浓度之比是
A.1 : 3 B.2 : 1 C.2 : 3 D.3 : 2
难度: 简单查看答案及解析
-
用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是
A. c (OH–) > c (H+)
B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L
C. c (CH3COOH) > c (CH3COO– )
D. c (CH3COO– ) + c (OH– ) = 0.2 mol/L
难度: 简单查看答案及解析
