-
化学是你,化学是我,化学深入我们生活,下列有关说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
C. 标准状况下,2.24L CH3CH2OH含有共价键数为0.8NA
D. 12.5mL 16mol·L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA
难度: 中等查看答案及解析
-
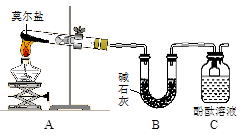
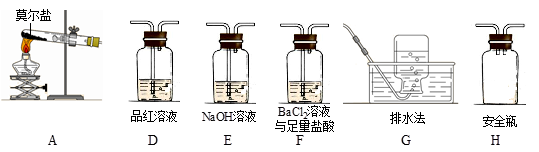
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )
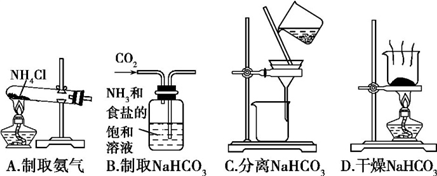
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
柠檬酸是常见的食品添加剂,其结构式如下图所示。以下叙述正确的是:( )
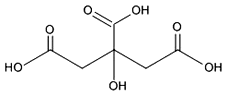
A. 柠檬酸分子式为C6H9O7
B. 使用食品添加剂属于违法行为
C. 柠檬酸可用作食品抗氧化剂,说明其有较强氧化性
D. 柠檬酸分子含三个羧基(-COOH)
难度: 中等查看答案及解析
-
锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
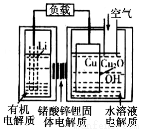
A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 mol•L-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )
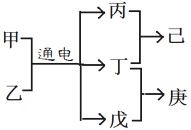
A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
难度: 困难查看答案及解析
-
常温下,下列叙述正确的是( )
A. pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,
 将减小
将减小D. 向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7
难度: 困难查看答案及解析