-
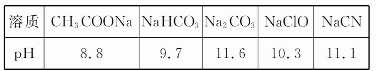
下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0. 1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。
A.②⑥⑦ B.③④⑥⑦ C.③④⑤⑥ D.①②
难度: 中等查看答案及解析
-
在中和滴定实验中,下列操作不影响测定结果的是( )
A.滴定管用蒸馏水洗净后,直接装滴定液
B.锥形瓶用蒸馏水洗净后,再用待测液润洗
C.滴定过程中,锥形瓶里的液体溅到瓶外
D.滴定前锥形瓶用蒸馏水洗涤
难度: 中等查看答案及解析
-
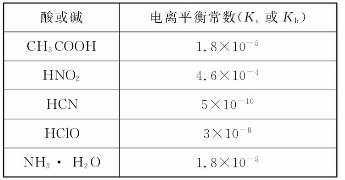
下列离子方程式正确的是( )
A.碳酸氢钠水【解析】
HCO3-+ H2OH3O+ + CO32-
B.醋酸铵溶于水:CH3COONH4 + H2O
CH3COOH + NH3·H2O
C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32- (aq)
CaCO3(s) + SO42- (aq)
D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++ SO42-+ Ba2++OH- ====BaSO4↓+ H2O
难度: 中等查看答案及解析
-
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸
B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸
C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸
D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸
难度: 中等查看答案及解析
-
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
A.x=y B.x >y C.x=10-2y D.x=102y
难度: 中等查看答案及解析
-
室温时,把10 mL pH=10的强碱溶液小心地加入到10 mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为( )
A.一元强酸 B.二元强酸 C.任何强酸 D.弱酸
难度: 中等查看答案及解析
-
常温下,在下列各组溶液中,加水稀释时c(H+)/c(OH-)明显增大,且能大量共存的离子组是( )
①K+、Cl-、NO3-、AlO2- ②K+、Fe2+、I-、SO42-
③Ba2+、OH-、NO3-、Na+ ④Na+、Ca2+、Al3+、Cl-
A.①② B.①③ C.②④ D.②③
难度: 中等查看答案及解析
-
常温下,pH=12的氨水中存在以下电离平衡:
NH3·H2O
NH4+ +OH- 。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是( )
A. c(NH4+) B. c(OH-) C. c(NH3·H2O) D.c(NH4+)·c(OH-)
难度: 中等查看答案及解析
-
下列液体均处于25 ℃,有关叙述正确的是( )
A.Na2CO3溶液中,c(OH-)-c(H+)=c(HCO3-) +2c(H2CO3)
B.AgCl在同浓度的MgCl2和KCl溶液中的溶解度相同
C.将稀氨水逐滴加入稀硫酸中,当溶液pH =7时,c(SO42-) >c(NH4+)
D.Na2S溶液加水稀释后,恢复至原温度,pH和Kw均减小
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性
B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强
C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O)
D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6
难度: 中等查看答案及解析
-
25 ℃时,Kw =1.0×10-14;100 ℃时,Kw =5.5×10-13。下列说法正确的是( )
A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7
C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7
D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
难度: 中等查看答案及解析
-
常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是( )
A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y)
B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-)
C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性
D.将NaHY晶体加入水中一定能促进水的电离
难度: 中等查看答案及解析
-
常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
( )
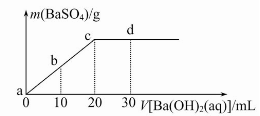
A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c (OH-)相等
D.c处溶液和d处溶液均呈碱性
难度: 中等查看答案及解析
-
常温下,浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;③CH3COONa溶液。下列说法不正确的是( )
A.溶液的pH:②>③>①
B.水电离出的c(OH-):③>①>②
C.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1 mol/L
难度: 中等查看答案及解析
-
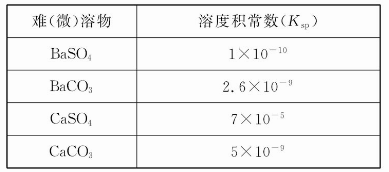
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )
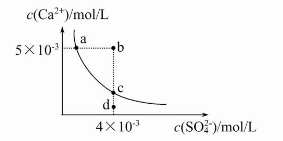
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
难度: 中等查看答案及解析
-
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB-
H++B2-
其中错误选项的组合是( )
A.①② B.③④ C.②③ D.①④
难度: 中等查看答案及解析