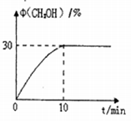
-
新版人民币的发行引发了人们对有关人民币中化学知识关注。下列表述不正确的是
A.制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B.用于人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
C.防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
D.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
难度: 中等查看答案及解析
-
设NA表示阿伏加罗常数的值,下列说法正确的是
A.常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA
B.含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA
C.2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA
D.25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是
A.质子数为7、中子数为8的氮原子:87N
B.溴化铵的电子式:
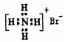
C.乙酸的比例模型:

D.间硝基甲苯的结构简式:
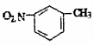
难度: 简单查看答案及解析
-
现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl═H++Cl-,判断HCl分子里存在离子键 ⑤有化学键断裂的变化属于化学变化
A.都不正确 B.①②⑤ C.②④⑤ D.①②③
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO-
B.0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I-
C.0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42-
D.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl-
难度: 中等查看答案及解析
-
纸电池是一种广泛应用的“软电池”,如图这种碱性电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是

A.Zn为负极,进行氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O═MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH)
难度: 困难查看答案及解析
-
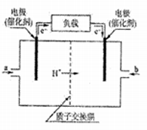
右下表为元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍。据此,下列说法中错误的是
A. X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反
B. Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增
C. 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性
难度: 困难查看答案及解析
-
分子式为C8H10的芳香烃具有的同分异构体有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 中等查看答案及解析
-
扑热息痛的结构如图所示
 下列关于扑热息痛的描述正确的是
下列关于扑热息痛的描述正确的是A.分子式为C8H10NO2
B.扑热息痛易溶于水
C.能与Na2CO3溶液反应,但不能与NaHCO3溶液反应
D.属于芳香烃
难度: 中等查看答案及解析
-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol•L-1NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B.加入CaCl2促进了HCO3-的电离
C.反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3)
难度: 中等查看答案及解析
-
常温下,饱和NaClO溶液的pH约为11。某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl。下列解释相关事实的离子方程式中不合理的是
A.该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-=HClO
B.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
C.常温下,该消毒液的pH≈11,是因为:ClO-+H2O
HClO+OH-
D.该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-=Cl2↑+H2O
难度: 中等查看答案及解析
-
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。右图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是

A.曲线①代表0.1 mol•L-1 KOH溶液滴定CH3COOH溶液的滴定曲线
B.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1
C.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
D.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)
难度: 困难查看答案及解析
-
已知:25℃时Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的K比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小
C.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
一定条件下,反应:6H2+2CO2
C2H5OH+3H2O的数据如下图所示

下列说法正确的是
A.该反应的△H>0
B.达平衡时,3v(H2)正=v(CO2)逆
D.b点对应的平衡常数K值大于c点
C.a点对应的H2的平衡转化率为90%
难度: 困难查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
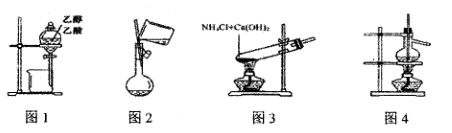
A. 用图1所示装置分离乙醇与乙酸
B. 用图2所示装置向容量瓶中转移液体
C. 用图3所示装置制备少量氨气
D. 用图4所示装置分馏石油
难度: 中等查看答案及解析