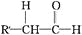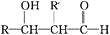-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 2.24 L乙烷中含有的共价键数为0.7NA
B. 1L0.1mol·L-1NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
C. 11g超重水(3H216O)中含有的中子数为6NA
D. 0.1mol N2 与0.3 mol H2 在一定条件下充分反应后,生成NH3 分子数为0.2NA
难度: 简单查看答案及解析
-
下列实验方案能达到实验目的的是
选项
实验方案
实验目的或结论
A
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
可证明氧化性:H2O2比Fe3+强
B
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀
说明Y中不含醛基
C
取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下)
测定铝箔中氧化铝的含量
D
比较不同反应的反应热数据大小
从而判断反应速率的大小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A. 不能判断溶液中是否存在SO42- B. 溶液中一定不存在CO32-
C. 不能判断溶液中是否存在Ag+ D. 不能判断是否含有AlO2-离子
难度: 困难查看答案及解析
-
有机物
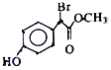 是一种扁桃酸衍生物,下列关于该有机物的说法正确的是
是一种扁桃酸衍生物,下列关于该有机物的说法正确的是A. 该有机物的分子式为C9H10O3Br
B. 分子中所有的碳原子一定在同一平面内
C. 1mol该有机物最多与2 molNaOH 反应
D. 该有机物的同分异构体中,属于一元羧酸和酚类化合物且苯环上只有2 个取代基的有12种
难度: 困难查看答案及解析
-
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
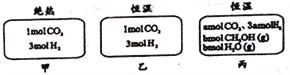
A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙
C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l
难度: 困难查看答案及解析
-
298 K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO- 的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )
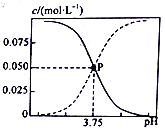
A. 298 K时,HCOOH 的电离常数Ka=1.0×10-10.25
B. 0.1mol·L -1HCOONa溶液中有c(HCOO-)+c(HCOOH)+c(OH- )<c(H+ )+0.1
C. 298 K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH- )增大
D. 0.1mol·L-1 HCOONa溶液和0.1mol·L-1 HCOOH 溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
难度: 中等查看答案及解析


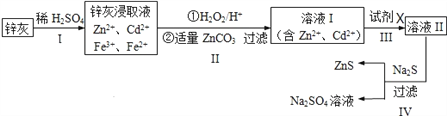
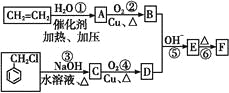
 ____________。
____________。 ___________。
___________。
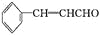 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: