-
化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正__________v逆(填“ >” < ”或“= ”)。
(3)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2 溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。
-
化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正__________v逆(填“ >” < ”或“= ”)。
(3)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2 溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。
-
碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g) S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g) S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
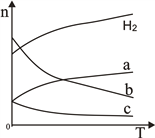
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为 ____________ 。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
-
下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为
的化学反应为

能提高燃煤烟气中 去除率的措施有_ _(填字母)。
去除率的措施有_ _(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使 转化为
转化为
采用方法Ⅰ脱硫,并不需要先出去燃煤烟气中大量的 ,原因是________(用离子方程式表示)。
,原因是________(用离子方程式表示)。
方法Ⅱ重要发生了下列反应:








 与
与 反应生成
反应生成 的热化学方程式为_。
的热化学方程式为_。
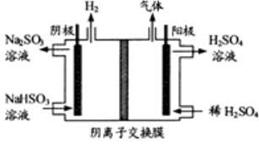
方法Ⅲ中用惰性电极电解 溶液的装置如右图所示。阳极区放出的气体的成分为________。(填化学式)
溶液的装置如右图所示。阳极区放出的气体的成分为________。(填化学式)
-
化学反应原理在生产和生 活中有广泛的应用。
活中有广泛的应用。
Ⅰ.NO2与SO2都是形成酸雨的主 要物质。在一定条件下,两者能发生反应:
要物质。在一定条件下,两者能发生反应:
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
(1)在一定条件下,将等物质的量的NO2、SO2气体置于体积固定的密闭容器中发生反应,下列能说明反应已经达到平衡状态的是
a.v(NO2)生成=v(SO2)消耗
b.混合气体的总压强不再改变
c.容器内气体颜色不再改变
d.容器内气体平均相对分子质量不再改变
(2)科学家正在研究利用催化技术将NO2和CO转变成无害的CO2和N2,反应的化学方程式:
2NO2(g)+4CO(g) 4CO2(g)+N2(g)+Q(Q>0)
4CO2(g)+N2(g)+Q(Q>0)
若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是 。
A.选用高效催化剂 B.充入NO2 C.降低温度 D.加压
Ⅱ.(1)17℃、1.01×105Pa,在2L密闭容器NO2和N2O4的混合气体达到平衡时,NO2的物质的量为0.2mol,N2O4的体积分数为6/11。计算该条件下反应2NO2(g) N2O4(g)的平衡常数K= 。若此时向容器中再充入0.1mol NO2和0.12mol N2O4,原化学平衡 移动(填“正向”、“逆向”或“不”)。
N2O4(g)的平衡常数K= 。若此时向容器中再充入0.1mol NO2和0.12mol N2O4,原化学平衡 移动(填“正向”、“逆向”或“不”)。
(2)现用一定量的Cu与足量的浓HNO3反应,制得2.20L(已折算到标准状况)已达到平衡的NO2 和N2O4的混合气体,理论上至少需消耗Cu g(保留两位小数)。
-
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g);△H1=—1160kJ/mo
CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g);△H2=—574 kJ/mol
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体
①该混合气体中NO和NO2的物质的量之比为 _______________
②在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
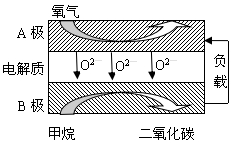
③B极为电池 极,电极反应式为_____________
④若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式 ,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下),实际上消耗的甲烷体积(折算到标况)比理论上大,可能原因为 .
-
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g); △H1
②CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g);△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量。
①该混合气体中NO和NO2的物质的量之比为________
②已知上述热化学方程式中△H1=—1160kJ/mol,则△H2=________
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式________。
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
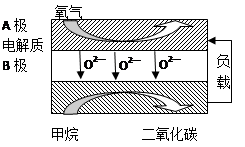
④B极为电池________极,电极反应式为________
⑤若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式________,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为________(标况下),实际上消耗的甲烷体积(折算到标况)比理论上大,可能原因为________.
-
(14分)硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式 。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图所示。电解时阳极区会产生气体,产生气体的原因是 。

(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
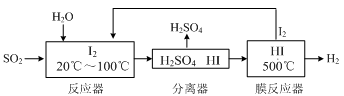
①用离子方程式表示反应器中发生的反应是 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
(3)氢化亚铜是一种红色固体,可由硫酸铜为原理制备
4CuSO4 + 3H3PO2 + 6H2O=4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应中还原剂是 (写化学式)。
②该反应每生成1molCuH,转移的电子物质的量为 。
(4)硫酸铜晶体常用来制取波尔多液,加热时可以制备无水硫酸铜。将25.0 g胆矾晶体放在坩埚中加热测定晶体中结晶水的含量,固体质量随温度的升高而变化的曲线如下图。
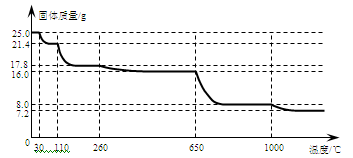
请分析上图,填写下列空白:
①30℃~110℃间所得固体的化学式是 ,
②650℃~1000℃间所得固体的化学式是 。
-
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)某科研小组用SO2为原料制取硫酸.
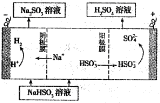
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池的负极的电极反应式______________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸.电解原理示意图如图1所示.电解时阳极区会产生气体,产生气体的原因是____________。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图2:
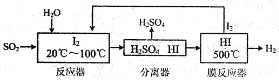
①用离子方程式表示反应器中发生的反应是______________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是______________。
(3)氢化亚铜是一种红色固体,可由硫酸铜为原理制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
①该反应中氧化剂是______________(写化学式)。
②该反应每生成1molCuH,转移的电子物质的量为______________。
(4)硫酸铜晶体常用来制取波尔多液,加热时可以制备无水硫酸铜.右图是硫酸铜晶体受热分解图示。请写出A→B的方程式______________。
-
硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:

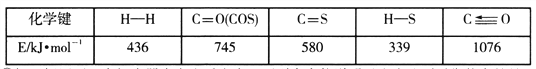
已知反应中相关的化学键键能数据如下表:
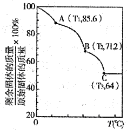
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率( )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
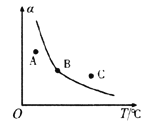
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为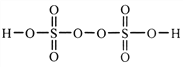
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)  HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
CH3OH(g),达到平衡后测得各组分的浓度如下:














