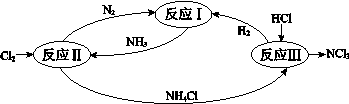
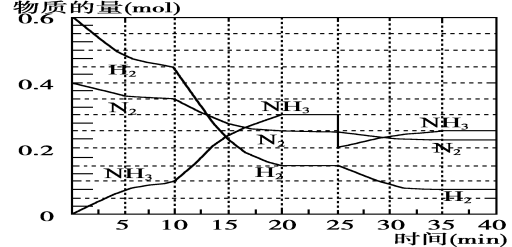
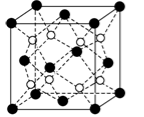
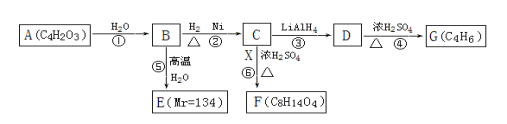
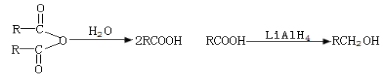
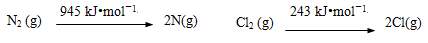-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶【解析】
再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀盐酸有气泡产生,震荡后仍有固体存在。
该白色粉末可能为( )
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
难度: 简单查看答案及解析
-
化学与生活密切相关,下列关于生活中的一些做法不科学的是 ( )
A.用SO2漂白纸
浆和草帽
B.Al(OH)3用于治疗胃酸过多
C.用小苏打发酵面团制作馒头
D.用较浓的氢氧化钠溶液洗涤衣服上的油污
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol·L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA
B.0.1mol•L-1 Na2SO3溶液中:c(Na+)+c(H+)=2c(SO3 2-)+c(HSO 3-)+c(OH-)
C.等浓度的系列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钾、⑥苯酚钠、⑦氢氧化钠、⑧硫酸,它们的PH由小到大排列的为①③⑤②⑥④⑦⑧
D.25℃,由水电离出的C(H+)=1×10-12 mol·L-1 的溶液中以下离子Na+、NH4+、I-、NO3-一定能大量共存
难度: 困难查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是( )

难度: 简单查看答案及解析
-
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++H++CO
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)=2[c(CO
)+c(HCO
)+c(H2CO3)
D.温度升高,c(HCO
)增大
难度: 简单查看答案及解析
-
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH
CH3COO-+H
+ K1=1.75×10-5
△H1>0
CH3COO-+H2O
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HA比HB更难电离,则NaA比NaB的水解能力更强
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多
D.常温下,向10 mL pH=12的氢氧化钠溶液中加入pH=2的HCl至pH=7,所得溶液的总体积>20 mL
难度: 简单查看答案及解析