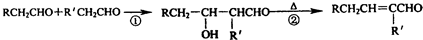-
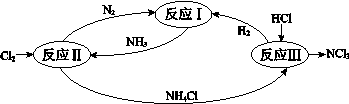
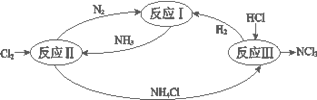
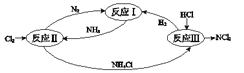
下图表示氮及其化合物在一定条件下的转化关系:
(1)根据反应I,在500℃、20MPa时,将N2和H2通入到 体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
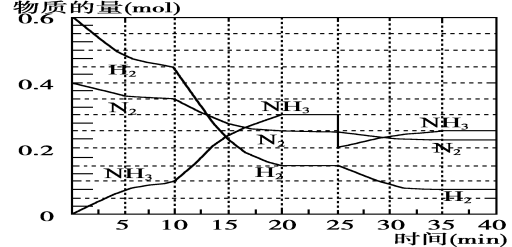
(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
a.加了催化剂
b.降低温度
c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是_______(填字母)。
a.3v(H2)正 = 2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d. N2、H2、NH3的分子数之比为1∶3∶2
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。
(5)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92.4 kJ•mol-1
2NH3(g) ΔH=–92.4 kJ•mol-1
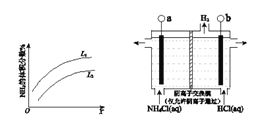
如图所示反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由_______ 。

(6)反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
已知: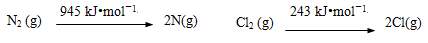
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_________ kJ。
-
下图表示氮及其化合物在一定条件下的转化关系:
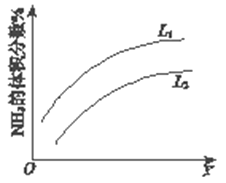
(1)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92 kJ•mol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
2NH3(g) ΔH=–92 kJ•mol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
(2)反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g)+6HCl(g)ΔH=–462 kJ•mol-1
已知: 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
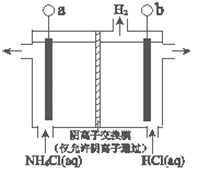
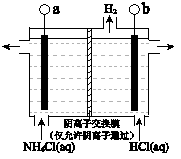
(3)反应III是利用下图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______(填“正”或“负”)。
②阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,该反应的离子方程式是_______。
-
下图表示氮及其化合物在一定条件下的转化关系:
(1)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92 kJ•mol-1
2NH3(g) ΔH=–92 kJ•mol-1
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。
(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJ•mol-1
已知:N2(g)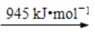 2N(g) Cl2(g)
2N(g) Cl2(g) 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)反应III是利用上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl NCl3 +3H2↑。
NCl3 +3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
-
下图表示氮及其化合物在一定条件下的转化关系:
(1)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92 kJ•mol-1右图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是__________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由___ 。
2NH3(g) ΔH=–92 kJ•mol-1右图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是__________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由___ 。

(2)① 反应II的化学方程式是___________。
② 反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
已知:
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_______ kJ。
(3)反应III是利用右图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl NCl3 +3H2↑。① b接电源的_______极(填“正”或“负”)。② 阳极反应式是_______。
NCl3 +3H2↑。① b接电源的_______极(填“正”或“负”)。② 阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是___________。
-
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g) 2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
| 1 MPa | 2 MPa | 3 MPa |
| 500℃ | 45.3% | | |
| 700℃ | a | 66.7% | |
| 900℃ | | | 73.6% |
下列说法正确的是
A.该反应的 H<0
H<0
B.45.3%<a<66.7%
C.该反应的平衡常数K(900℃)>K(700℃)
D.700℃、2 MPa时R的转化率为50%
-
(15分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·H2O表示。在一定条件下有如下图所示的转化关系:
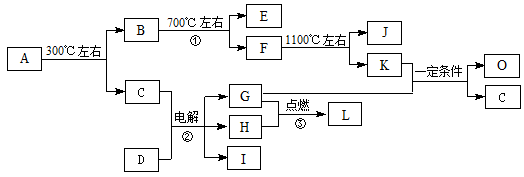
已知:
① 经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③ 反应②、③是重要的化工反应,I是一种重要的化工原料。
④ 上图中的部分变化经定量测定,得到如下图所示的固体产物的质量分数[ω(%)]随温度[T(℃)]的变化曲线。
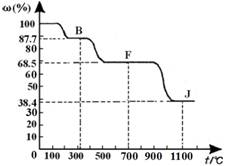
回答下列问题:
(1)写出A的化学式:▲ ,D中阴离子的结构示意图为▲ ;
(2)反应①的化学方程式为:▲ 。
(3)写出电解反应②的化学方程式,并标出电子转移的方向和数目:▲ 。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为:▲ 。
② 若O是K与G按1∶3的比例反应而得,则O可能是▲ 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
-
(10分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
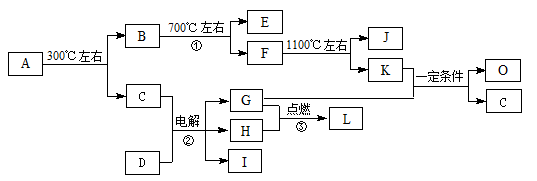
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
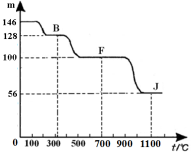
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
-
(7分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
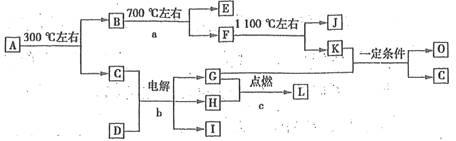
已知:①上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是l:1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
②G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入,会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的主要原因。
③反应b、c是重要的化工反应,I是一种重要的化工原料。
④转化关系图中的部分变化经定量测定,得到如右图所示的固体产物的质量分数[ (%)]随温度[T(℃)]的变化曲线。
(%)]随温度[T(℃)]的变化曲线。

回答下列问题:
(1)写出A的化学式:________,D阴离子的示意图________。
(2)反应a的化学方程式为________。
(3)写出电解反应b的化学方程式,并标出电子转移的方向和数目:________。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也可减少对环境的污染。若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明。则O的分子式为________。
-
已知醛在一定条件下可以发生如下转化:
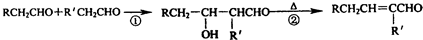
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题:

(图中C为:C9H8O2;H为:C18H20O2
(1)A分子所含官能团为:________,B的结构简式为:________;
(2)E→F的反应类型是________(填序号).
a.还原反应 b.加成反应 c.取代反应 d.消去反应
(3)G、D反应生成H的化学方程式是:________.
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为:________(不包括G本身).
-
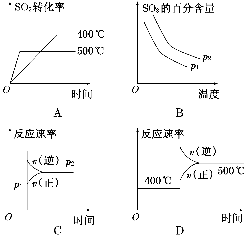
可逆反应2SO2(g)+O2(g)2SO3(g),根据下表中的数据判断下列图像错误的是( )
| 压强 转化率 温度 | p1(MPa) | p2(MPa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |

体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

2NH3(g) ΔH=–92.4 kJ•mol-1
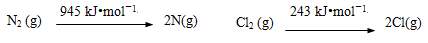


 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。


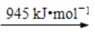 2N(g) Cl2(g)
2N(g) Cl2(g)