-
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是( )
A.采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质
B.CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成
C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济
D.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.乙烯的比例模型:
B.HClO的结构式:HClO
C.H2O2的电子式:
D.乙醇的分子式:CH3CH2OH
难度: 中等查看答案及解析
-
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6).下列有关该反应的说法正确的是( )
A.Cl2作还原剂
B.碱性条件下,NaIO3的氧化性强于Na2H3IO6
C.每生成1 mol Na2H3IO6,转移2 mol电子
D.氧化产物与还原产物的物质的量之比为2:1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO32-
B.1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO42-
C.1.0 mol·L-1的KI溶液:Na+、Fe3+、Cl-、SO42-
D.澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl-
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )

A.图1定量测定H2O2的分解速率
B.图2装置制备Fe(OH)2并能较长时间观察其颜色
C.图3装置测量Cu与浓硝酸反应产生气体的体积
D.图4证明CH3CH2OH发生消去反应生成了乙烯
难度: 中等查看答案及解析
-
下列有关物质的性质与应用相对应的是( )
A.氢氟酸具有弱酸性,可用于雕刻玻璃
B.Na2O2具有强氧化性,可用作自来水的消毒剂
C.氯化铁溶液能氧化铜单质,可用于制作印刷电路板
D.SO2具有漂白性,可使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法一定正确的是( )
A.9.2 g C7H8和C3H8O3的混合物中所含氢原子总数为0.8NA
B.标准状况下,11.2 L C2H5OH中所含的分子数为0.5NA
C.将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒
D.0.1 mol Na2O2参加反应转移的电子数目是0.2NA
难度: 中等查看答案及解析
-
下列物质转化在给定条件下不能实现的是( )
①Si
SiO2
H2SiO3;②S
SO3
H2SO4;③C
CO2
Na2CO3
④MgCl2溶液
MgCl2·6H2O
Mg;⑤Na
Na2O2
NaOH
A.①②③ B.①②④ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.向苯酚溶液中滴加Na2CO3溶液:
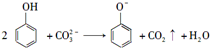
D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是( )
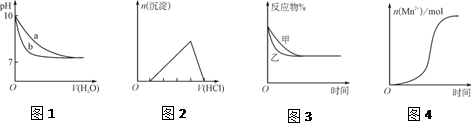
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
难度: 中等查看答案及解析
-
贝诺酯是一种治疗类风湿性关节炎药物,其结构简式如右图所示(未表示出其空间构型)。下列关于贝诺酯的描述正确的是( )

A.贝诺酯的分子式为C17H15NO5
B.贝诺酯中含有3种含氧官能团
C.贝诺酯能使溴水和酸性高锰酸钾溶液都褪色
D. 1 mol贝诺酯最多可以消耗9 mol H2
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是( )
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.Z的最高价含氧酸的酸性强于W的最高价含氧酸的酸性
D.原子半径的大小顺序:rW>rZ>rY>rX
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是( )
选项 实验操作 实验现象 结论
A 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 2 min后,试管里出现凝胶 酸性:盐酸>硅酸
B 在酒精灯上加热铝箔 铝箔熔化但不滴落 熔点:氧化铝>铝
C 常温下,向浓硫酸中投入铁片 铁片不溶解 常温下,铁不与浓硫酸反应
D 向某溶液中先滴加KSCN溶液,再滴加少量氯水 先无明显现象,后溶液变成血红色 溶液中含有Fe2+,没有Fe3+
难度: 中等查看答案及解析
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是( )
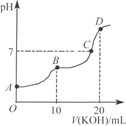
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
难度: 困难查看答案及解析
-
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
甲
乙
反应物投入量
1 mol N2、3 mol H2
4 mol NH3
NH3的浓度(mol·L-1)
c1
c2
反应的能量变化
放出a kJ
吸收b kJ
气体密度
ρ1
ρ2
反应物转化率
α1
α2
(已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是( )
A.c1<c2<2c1 B.a+b>92.4 C.α1+α 2=1 D.ρ2=2ρ1
难度: 困难查看答案及解析