-
分类法是学习化学常用的方法。下列分类方法不正确的是( )
①根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 ②根据物质在常温下的状态,可以从硅、硫、铜、铁、氮气中选出氮气 ③根据组成元素的种类,将纯净物分为单质和化合物 ④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 ⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物 ⑥根据盐在水中的溶解度,将盐分为硫酸盐、碳酸盐、钾盐和铵盐
A. ①④⑤⑥ B. ③④⑤⑥
C. 只有①③ D. 全部
难度: 中等查看答案及解析
-
下列关于溶液的叙述正确的是( )
A. 所有溶液都是无色的
B. 由分散质和分散剂组成的分散系一定是溶液
C. 均一稳定的液体是溶液
D. 溶液是由溶质和溶剂组成的
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. H2SO4 的摩尔质量是 98 g
B. 1 mol H2O 的质量是 18 g/mol
C. Cl-的摩尔质量是 35.5 g/mol
D. 1 mol N2 的体积是 22.4 L
难度: 简单查看答案及解析
-
下列物质中含原子个数最多的是 ( )
A. 0.4 mol O2
B. 4 ℃ 时 5.4 mL 水
C. 10 g 氖
D. 6.02×1022 个 CO2 分子
难度: 简单查看答案及解析
-
与1.8 g H2O 含有相同氢原子数的 H2SO4 是( )
A. 9.8 g B. 19.6 g
C. 0.15 mol D. 0.2 mol
难度: 简单查看答案及解析
-
某硫酸铝溶液中,含 Al3+ a g,则溶液中 SO
的物质的量为 ( )
A.
mol B.
mol
C.
mol D.
mol
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
难度: 简单查看答案及解析
-
若某原子的摩尔质量为M g·mol-1,则一个该原子的真实质量是 ( )
A. M g B.
g
C.
g D.
g
难度: 中等查看答案及解析
-
下列关于 0.2 mol/L 硝酸钾溶液的叙述中,正确的是 ( )
A. 1 L 该溶液中含硝酸钾 202 g
B. 100 mL 该溶液中含硝酸钾 0.02 mol
C. 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L
D. 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B. 在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C. 不同的气体,若体积不同,则它们所含的分子数一定不同
D. 气体摩尔体积是指1mol任何气体所占的体积约为22. 4L
难度: 中等查看答案及解析
-
下列实验操作中,错误的是 ( )
A. 蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
对下列物质分类全部正确的是( )
①小苏打 ②食盐水 ③石灰水
④NaOH ⑤液态氧 ⑥KClO3
A. 碱—①④ B. 纯净物—③④⑤
C. 盐—①⑥ D. 混合物—②⑤
难度: 简单查看答案及解析
-
符合如图中阴影部分的物质是( )
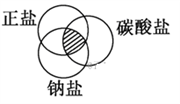
A. NaHCO3 B. Cu2(OH)2CO3
C. NaCl D. Na2CO3
难度: 简单查看答案及解析
-
下列实验装置或操作与粒子的大小无直接关系的是( )
A.
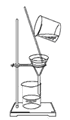 过滤 B.
过滤 B.  渗析 C.
渗析 C. 萃取 D.
 丁达尔效应
丁达尔效应难度: 中等查看答案及解析
-
下列实验过程中先产生沉淀后沉淀溶解,且产生沉淀和沉淀消失的过程均是化学变化的是( )
A. 向澄清石灰水中持续通入CO2气体
B. 向Al(OH)3胶体中持续滴加H2SO4溶液
C. 向Fe(OH)3胶体中持续滴加Na2SO4溶液
D. 向AgNO3溶液中持续滴加HCl溶液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. SO3 、NH3的水溶液均能导电,所以均是电解质
B. 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质
C. 液态硫酸、固态硫酸钡不能导电,所以二者均不是电解质
D. 钢铁、石墨均导电,所以它们是电解质
难度: 简单查看答案及解析
-
某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
检测序号
溶液中检测出的离子组合
第一次
KCl、K2SO4、Na2CO3、NaCl
第二次
KCl、AlCl3、Na2SO4、K2CO3
第三次
Na2SO4、KCl、K2CO3、NaCl
下列说法合理的是( )
A. 三次检测结果都正确
B. 该溶液中的阳离子无法判断
C. 为了检验SO
,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D. 为了确定是否存在CO
,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
难度: 简单查看答案及解析
-
下列化学方程式中,不能用H++OH-===H2O表示的是( )
A. 2NaOH+H2SO4===Na2SO4+2H2O
B. Ba(OH)2+2HCl===BaCl2+2H2O
C. Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
D. KOH+HCl===KCl+H2O
难度: 简单查看答案及解析
-
离子方程式:CO
+2H+===CO2↑+H2O表示( )
A. 碳酸盐和盐酸之间的反应
B. 一切碳酸盐与一切酸之间的反应
C. 可溶性碳酸盐与酸之间的反应
D. 可溶性碳酸盐与强酸之间的反应
难度: 简单查看答案及解析
-
在无色透明溶液中,下列各组离子能大量共存的是( )
A. Cu2+ 、K+、Cl-、NO
B. Ag+、Na+、NO
、Cl-
C. Zn2+、Al3+、SO
、Cl- D. Ba2+、NH
、Cl-、CO
难度: 简单查看答案及解析
-
在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的离子组是( )
A. Mg2+、Na+、Cl-、CO
B. Ba2+、K+、OH-、NO
C. H+、Fe3+、NH
、SO
D. Na+、Ca2+、Cl-、HCO
难度: 中等查看答案及解析
