-
能在溶液中大量共存、且加入(NH4)2Fe(SO4)2•6H2O晶体后仍能大量存在的离子组是( )
A.Cu2+、S2-、Br-、ClO-
B.K+、Ca2+、OH-、I-
C.K+、H+、Cl-、NO3-
D.Na+、Mg2+、Cl-、SO42-难度: 中等查看答案及解析
-
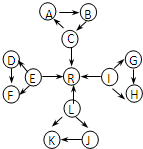
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:
①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.
下列推断不正确的是( )
A.肯定没有NH4+、HCO3-、MnO4-
B.可能有K+、Cl-
C.肯定有Al3+、Mg2+、SO42-
D.可能有K+、Cl-、HCO3-难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A.高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一
B.发展低碳经济,推广可利用太阳能的城市照明系统有利于节能减排、改善环境质量
C.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
D.节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.HClO的电子式:
B.丙烷分子的比例模型:
C.Ar原子的结构示意图: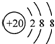
D.某种和田玉的化学成分为:Ca2Mg5Si8O22(OH)2,可用氧化物表示为:2CaO•5MgO•8SiO2•H2O难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A.1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
B.常温下,11.2L甲烷和乙烯的混合物所含有的氢原子数等于2NA
C.7.8g过氧化钠与CO2充分反应,转移的电数为0.1NA
D.常温常压下,1mol氦含有原子数为NA难度: 中等查看答案及解析
-
据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1mol O2(PtF6)则转移1mol电子
D.在O2(PtF6)中不存在共价键难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.硫酸铜溶液中加过量的氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+
B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+═Ca2++CO2↑+H2O
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O═C6H5OH+HCO3-
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+═NO↑+I2+H2O难度: 中等查看答案及解析
-
有一个铝罐充满X气体,当向其中加入足量的Y溶液并迅速将开口密封,发现该铝罐先瘪下,后又慢慢鼓起.则X、Y可能分别为( )
①Cl2、NaOH ②CO2、NH3.H2O ③NH3、浓H2SO4 ④NH3、稀H2SO4.
A.①③
B.①②
C.②③
D.①④难度: 中等查看答案及解析
-
有四种溶液分别含有下列微粒:①Fe2+ ②HSO3- ③CH2=C(NH2)-COOH ④C6H5O-,若分别向其中加入一定量的酸性KMnO4、浓盐酸或KOH固体,均能使微粒物质的量明显减少的是( )
A.①②
B.①④
C.②③
D.②④难度: 中等查看答案及解析
-
某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol•L-1的下列各溶液pH最大的是( )
表:几种弱酸的电离平衡常数酸 电离常数 CH3COOH Ka=1.8×10-5 HClO Ka=3.0×10-8 H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11 H3PO4 Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13
A.CH3COONa
B.NaClO
C.Na2CO3
D.Na3PO4难度: 中等查看答案及解析
-
A、B、C、D、E是短周期五种元素,其原子序数逐渐增大.其中A与C是同族元素,B、E两元素间可形成酸雨,B、D简单离子具有相同的核外电子排布结构.下列说法正确的是( )
A.氢化物的沸点:B<E
B.简单离子半径:B>D
C.元素A与元素B不能形成化合物A2B2,但元素B与C能形成化合物C2B2
D.元素D最高价氧化物一定能溶于强碱溶液难度: 中等查看答案及解析
-
下列有关实验方面的叙述正确的是( )
A.把火柴头摘下浸泡水中,然后取少量浸泡液于试管中,滴入AgNO3和稀硝酸,以检验Cl-
B.用25.00 ml 酸式滴定管准确量取20.00 ml KMnO4溶液
C.水杨酸与乙酰水杨酸(阿司匹林)遇FeCl3溶液都能变紫色
D.纸上层析时,用毛细管蘸取试样在滤纸上点样要浓,斑点直径要尽可能大难度: 中等查看答案及解析
-
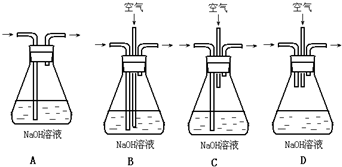
取等体积、等浓度的两份NaOH溶液,把其中一份A放在空气中一段时间,另一份B密封保存;用已知浓度的硫酸溶液中和上述两份溶液,若所消耗的硫酸溶液体积分别为VA和VB,则下列说法正确的是( )
A.若用甲基橙作指示剂,VA>VB
B.若用甲基橙作指示剂,VA<VB
C.若用酚酞作指示剂,VA>VB
D.若用酚酞作指示剂,VA<VB难度: 中等查看答案及解析
-
如图,X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色、无味的气泡产生.下列符合此现象的是( )
a极板 b极板 Y电极 C溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 钢 石墨 负极 CuCl2 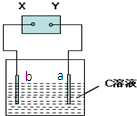
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知常温下:pH(NaHCO3)>7>pH(NaHSO3).则在NaHCO3或NaHSO3溶液中,有关微粒的物质的量浓度表示式一定正确的是(X表示S或C)( )
A.C(Na+)>C(HXO3-)>C(OH-)>C(H2XO3)>C(XO32-)
B.C(Na+)+C(H+)=C(OH-)+C(XO32-)+C(HXO3-)
C.C(H2XO3)+C(HXO3-)+C(XO32-)=C(Na+)
D.C(OH-)=C(H+)+C(HXO3-)+C(H2XO3)难度: 中等查看答案及解析
-
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
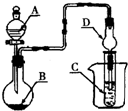
A.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色
B.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
D.若A为浓硫酸,B为炭,C中盛有苯酚钠溶液,则C中出现白色混浊难度: 中等查看答案及解析
-
牙釉质的主要成分羟基磷灰石[Ca10(PO4)6(OH)2]在水中能极少溶解Ca10(PO4)6(OH)2(s)⇌10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]=2.35×10-59,Ksp[Ca10(PO4)6F2]=7.1×10-61,Ksp[CaCO3]=5×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )
A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口
B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿
C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大
D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2难度: 中等查看答案及解析
-
已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:I=kc•L(式中k为常数).如图所示,则下列说法正确的是( )

A.从甲中的视线1观察到颜色变浅
B.从乙中的视线1观察到颜色变深
C.从乙中的视线2观察到颜色不会变化
D.探究压强对化学平衡的影响时,应从视线2观察难度: 中等查看答案及解析