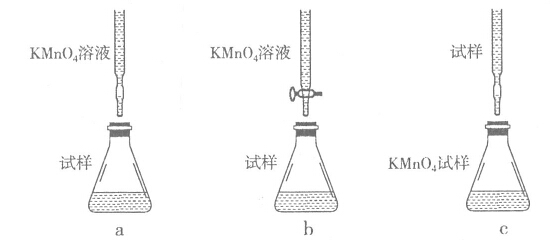
-
2015年8月12日天津港瑞海公司危险化学品仓库发生特大火灾爆炸事故,事故警示我们,化学药品的安全存放是非常重要的。下列有关化学药品的存放说法不正确的是
A.液溴易挥发,应用少量的水液封并放在冷暗处保存
B.硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存
C.金属钠遇到氧气和水均立即反应,应保存在煤油或者液体石蜡中
D.碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
难度: 简单查看答案及解析
-
下列说法不正确的是(NA表示阿佛加德罗常数)
A.含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B.4.6 g Na与足量的稀盐酸反应,转移电子数一定为0.2NA
C.1L 0.1mol·L-1的Na2CO3中CO32-数目小于0.1 NA
D.常温下,22g CO2含碳氧双键数目为NA
难度: 困难查看答案及解析
-
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.提高溶液的温度
B.将溶液稀释到原体积的10倍
C.加入适量的醋酸钠固体
D.加入等体积0.2 mol·L-1盐酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.H2、SO2、CO均可用浓硫酸干燥
B.固态共价化合物不能导电,熔融态的共价化合物能导电
C.SO2通入氯化钡溶液中生成白色沉淀
D.酸性氧化物一定是非金属氧化物,因此不能与酸溶液发生反应
难度: 简单查看答案及解析
-
下列不能用勒夏特列原理解释的是
A.用加压的方法促进CO2在水中的溶解
B.合成氨工业用铁触媒作催化剂
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
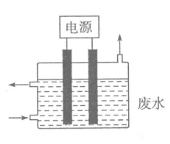
科研人员设想用右图所示装置生产硫酸,下列说法正确的是

A.a为正极,b为负极
B.负极反应式为2H2O+SO2-2e-=SO42-+4H+
C.电子从b极向a极移动
D.生产过程中H+由b电极区通过质子膜向a电极区运动
难度: 中等查看答案及解析
-
下列有关NaHSO3溶液的叙述正确的是
A.该溶液中K+、Ca2+、ClO-、Br-可以大量共存
B.能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性
C.NaHSO3溶液c (Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
D.和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O
难度: 中等查看答案及解析
-
某电动汽车使用的是高铁电池,其总反应为
3Zn(OH)2+2Fe(OH)3+4KOH
3Zn+2K2FeO4+8H2O,下列说法正确的是
A.放电时,若有6mol电子发生转移,则有2mol K2FeO4被氧化
B.放电时,正极反应为:FeO42-+4H2O+3e-===Fe(OH)3+5OH-
C.充电时,电池的负极与外接电源的正极相连
D.充电时,阴极附近溶液的pH变小
难度: 中等查看答案及解析
-
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下,分析图象以下结论错误的是
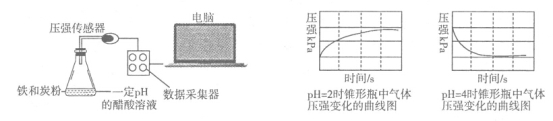
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
下列实验现象与对应结论均正确的是
选项
操作
现象
结论
A
KI淀粉溶液中滴入氯水,再通入SO2
先变蓝色后褪色
SO2有漂白性
B
用洁净铂丝蘸取无色溶液进行焰色反应
火焰呈黄色
无色溶液为钠盐溶液
C
向白色ZnS沉淀上滴加0.1mol/LCuSO4溶液
沉淀变为黑色
Ksp(ZnS)>Ksp(CuS)
D
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
难度: 中等查看答案及解析
-
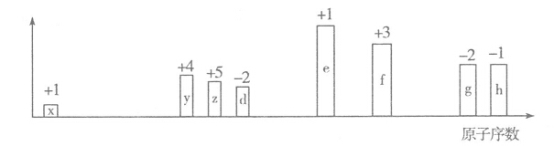
短周期元素X、Y、Z、W的原子序数依次增大,Y、Z、W位于同一周期,它们的最高价氧化物的水化物能两两反应,X原子最外层电子数是电子层数的三倍,W的最高正价与最低负价的代数和为4。下列推测不正确的是
A.X的非金属性强于W
B.X与Y可形成的离子化合物不止一种
C. W元素最高价氧化物对应水化物的化学式为H2WO4
D.Y、Z的简单离子都能破坏水的电离平衡
难度: 中等查看答案及解析
-
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
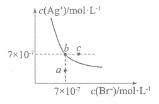
A.图中a点对应的是AgBr的不饱和溶液
B.在t℃时,Ksp(AgBr)=4.9×10-13
C.在t℃时,AgCl(s)+Br-(aq)
AgBr(s)+C1-(aq)的平衡常数K≈816
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到c点
难度: 困难查看答案及解析
-
二氯化二硫(S2C12)的结构式为Cl—S—S—Cl,易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应下列说法正确的是
A.S2C12做氧化剂,H2O做还原剂
B.氧化产物与还原产物的物质的量之比为l:3
C.每生成l mol SO2转移4 mol电子
D.每生成48g硫会断裂6mol共价键
难度: 困难查看答案及解析
-
下列各溶液中,有关微粒的物质的量浓度的叙述正确的是
A.25℃时,NH4Cl与NH3·H2O混合溶液中:c(C1-)>c(NH4+)>c(OH-)>c(H+)
B.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.将pH=2 HCl与pH=12 NH3·H2O溶液等体积混合,混合后溶液中c(H+)=c(OH-)
D.0.01mol·L-1Na2CO3溶液与0.01mol·L-1NaHCO3溶液等体积混合一定存在:
3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+)
难度: 困难查看答案及解析
-
下列图示与对应的叙述一定正确的是

A.图l所示,反应:X(g)+2Y(g)===3Z(g),b的压强一定比a大
B.图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2,则:T1<T2,K1>K2
C.图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性: c>b>a
难度: 中等查看答案及解析