-
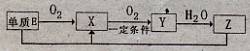
在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为 ( )
A.单质 B.分子 C.元素 D.氧化物
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属
B.不含金属元素的化合物也可能是离子化合物
C.变价金属一定是过渡元素
D.显酸性的溶液中溶质只能是酸或强酸弱碱盐、
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法。下列分类方法中,不正确的是 ( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属。
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧他物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑨根据化学反应的热效应,将化学反应分为放热反应、吸热反应
A.只有①③ B.③④⑤⑥ C.①④⑤⑧ D.全部正确
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是 ( )
A.18gNH+4中含有的电子数为10NA
B.78gNa2O2固体中含有的阴离子数为2NA
C.1L0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.标准状况下,2.24L苯含有分子的数目为0.1NA
难度: 中等查看答案及解析
-
“类推”是常用的学习方法,但是有时会产生错误结论。下列类推结论中,。正确的是 ( )
A.ⅣA族元素氢化物沸点顺序是GeH4> SiH4>CH4;则VA族元素氢化物的沸点顺序也是AsH3>PH3>NH3
B.第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则笫三周期元素氢化物稳定性的顺序也是HCI>H2S>PH3
C.晶体中有阴离子必有阳离子;则有阳离子也必有阴离子
D.酸性:HCl>H2S,所以,非金属性:C1>S
难度: 中等查看答案及解析
-
若在加入铝粉能产生氢气的溶液中分别加入下列各组离子,可能大量兴存的一组是
A.NH+4、NO-3、CO2-3、Na+ B.Na+、Ba2+、Mg2+、HCO-3
C.NO+3、Fe2+、Cl-、Ca2+ D.NO-3、Na+、K+、Cl-
难度: 中等查看答案及解析
-
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaHSO4溶液和Na2CO3溶液 B.稀盐酸和AgNO3溶液
C.AlCl3溶液和NH3·H2O溶液 D. Ba(OH)2溶液和NaHCO3溶液
难度: 中等查看答案及解析
-
右图是元素周期表短周期的一部分。
若A原子最外层的电子数比次外层的电子数少3, 则下列说法中正确的是( )
A.D与C不能形成化合物
B.D的最高正价与B的最高正价相等
C.A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A
D.原子半径的大小顺序是C>B>A>D
难度: 中等查看答案及解析
-
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘131和铯137(
)向外界泄漏。下列相关说法错误的是 ( )
A.每个
原子中有82个中子 B.CsOH的碱性比KOH强
C.KIO3是碘的最高价氧化物的水化物的盐 D.I—比F—还原性强
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.原子最外层电子数为2的元素一定是金属元素
B.元素周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,、气态单质的分子都是由非金属元素的原子形成的
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列各项叙述中正确的有 ( )
①0.2mol H2O2完全分解转移的电子数为0.4 NA
②25℃、101 Pa下,16gO3和O2混合气体中含有的氧原子数为NA
③将FeCl3的饱和溶液(含FeCl3 0.1mol)加入沸水中充分作用制成胶体,其中含有胶体粒子的数目为0.1NA
④l mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.②④ B.①②③④ C.①②③ D.①②④
难度: 中等查看答案及解析
-
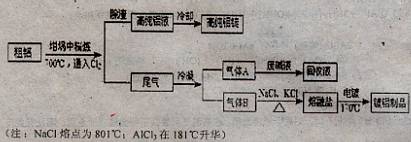
从海水中提取镁的主要步骤;①把贝壳烧成生石灰; ②在海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤; ④在氯化氢热气流中加热晶体;⑤电解上述所得盐。下列说法不正确的是 ( )
A.上述变化包括了分解反应、化合反应、复分解反应类型
B.贝壳烧成生石灰属于吸热反应
C.在氯化氢热气流中干燥晶体的目的是为了抑制阳离子的水解
D.步骤⑤也可以采用电解该盐水溶液的方法
难度: 中等查看答案及解析
-
将下列备组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、干冰、硫酸、烧碱、食盐
B.碘酒、冰、盐酸、火碱、食盐
C.氢气、二氧化硫、硝酸、纯碱、胆矾
D.铜、氧化铜、醋酸、石灰水、氯他铜
难度: 中等查看答案及解析
-
下列离子方程式中正确的是 ( )
A.Ba(OH)2溶液中加NaHSO4溶液至中性:
B.NH4HCO3溶液与过量KOH浓溶液共热:
C.稀硝酸和过量的铁屑反应:
D.KI溶液与H2SO4酸化的H2O2溶液混合:
难度: 中等查看答案及解析
-
等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述不正确的是 ( )
A.金属AI无剩余 B.c(Na+)=c(AlO-2)
C.所得溶液呈碱性 D.Na的物质的量是0.6mol
难度: 中等查看答案及解析
-
两种微粒含有相同的质子数和电子数,这两种微微粒可能是 ( )
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
难度: 中等查看答案及解析
-
36.5HCl溶解在1L水中(水的密度近似为1gml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量溶液为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度:c=1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5g HCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
难度: 中等查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期、A、C的最低价离子分别为A2-和C-,B2+和C—具有相同的电子层结构,下列说法正确的是 ( )
A.C元素的最高正价为+7价 B.离子半径:A2->C->B2+
C.对应气态氢化物的稳定性:A>C D.还原性:A2-<C-
难度: 中等查看答案及解析
-
某溶液中大量存在四种离子:NO-3、SO2-4、H+、M,其物质的量之比为:N(NO-3):n(SO2-4):n(H+):n(M)=3:1:3:1,则M可能为 ( )
①Fe2+ ②Mg2+ ③Cl— ④Ba2+
A.①②④ B.③ C.② D.①②
难度: 中等查看答案及解析
-
已知I2+SO2-3+H2O=2I-+SO2-4+2H+。某无色溶液中可能含有I-、NH+4、Cu2+、SO2-3,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液的判断正确的是( )
①肯定不含I— ②肯定不含Cu2+ ③肯定含有SO2-3 ④可能含有I—
A.②③④ B.①②③ C.①③ D.①②
难度: 中等查看答案及解析
-
21.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。

原溶液中Cl—与SO42+的物质的量之比为( )
A.1:3 B.2:3
C.6:1 D.3:1
难度: 中等查看答案及解析