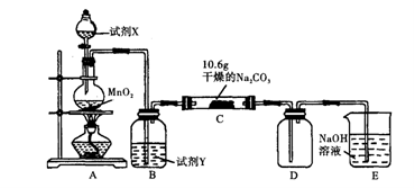
-
下列物质的使用不涉及化学变化的是
A.液氨作致冷剂 B.硝酸银溶液保存在棕色试剂瓶中
C.葡萄酿酒 D.过氧化氢溶液作消毒水
难度: 中等查看答案及解析
-
下列各项比较中前者高于(或大于或强于)后者的是
A.CH4和SiH4的熔点
B.I2在H2O中的溶解能力和I2在CCl4中的溶解能力
C.H2SO3和H2SO4的酸性
D.对羟基苯甲醛(
)和邻羟基苯甲醛(
)的沸点
难度: 中等查看答案及解析
-
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物;Z、W、M是第三周期原子序数连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述正确的是
A.X、M两元素的简单气态氢化物的稳定性:X<M
B.X、Y、M的最高价氧化物的水化物的酸性:X>Y>M
C.Z、W的单质均可在冷的浓硝酸中钝化
D.Z、W、M 的单质均能与NaOH溶液反应
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+
O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①② B.②③ C.②③④ D.①②③
难度: 中等查看答案及解析
-
一定温度下,在体积为10L的密闭容器中充满NH3,进行如下反应:
2NH3(g)
3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L。下列叙述中不正确的是
A.NH3在5s内的平均速度为
mol/(L·s)
B.达到平衡时NH3的分解率为40%
C.N2的平衡浓度为
mol/L
D.反应开始时与平衡时的压强比为5∶7
难度: 中等查看答案及解析
-
对于可逆反应A(g) + 2B(g)
2C(g) ΔH>0,下列图象正确的是
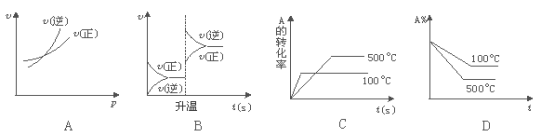
难度: 中等查看答案及解析
-
对实验甲、乙、丙、丁的叙述不正确的是
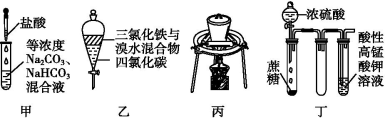
A.实验甲:逐滴滴加盐酸时,开始无明显现象,然后才有大量气泡产生
B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验丙:可测定胆矾晶体中结晶水的质量分数
D.实验丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅至褪去
难度: 中等查看答案及解析