-
在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是
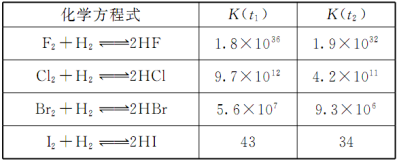
A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2与H2反应的剧烈程度随着原子序数递增逐渐减弱
D.HX的稳定性:HBr>HI
-
(16分)(一)在温度 和
和 下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2 2HF 2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2 2HCl 2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2 2HBr 2HBr | 5.6×107 | 9.3×106 |
| I2+H2 2HI 2HI | 43 | 34 |
(1)已知t2>t1,生成HX的反应是 反应(填“吸热”或“放热”)。
(2)用电子式表示HCl的形成过程 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 (用化学式表示)。
(4)K的变化体现出X2化学性质的递变性,用原子结构解释原因是 。
(二)下图表示一些晶体结构,它们分别是晶体干冰、金刚石、氯化铯、氯化钠某一种的某一部分。

(5)代表金刚石的是 (选填字母);晶体中碳原子与C—C键数目之比是 。
(6)上述B、C、D三种物质熔点由高到低的排列顺序为 (用字母表示)。
(7)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<,>或=”)。
-
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:

下列说法正确的是
A.在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低
B.t2>t1,HX的生成反应是吸热反应
C.随着卤素原子核电荷数的增加HX的还原性逐渐减弱
D.随着卤素原子核电荷数的增加HX的稳定性逐渐增强
-
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
| F2+H2  2HF 2HF | 1.8 ×1036 | 1.9 ×1032 |
| Cl2+H2  2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
| Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
| I2+H2  2HI 2HI | 43 | 34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
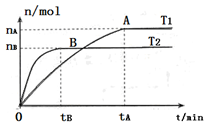
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式________、________。
-
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
F2+H2 2HF 2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2 2HCl 2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2 2HBr 2HBr | 5.6×107 | 9.3×106 |
I2+H2 2HI 2HI | 43 | 34 |
(1)已知t2>t1,HX的生成反应是______反应(填“吸热”或“放热”).
(2)HX的电子式是______.
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是______.
(4)X2都能与H2反应生成HX,用原子结构解释原因:______.
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:______,原子半径逐渐增大,得电子能力逐渐减弱.
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,______(选填字母).
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱.
-
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2⇌2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2⇌2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2⇌2HBr | 5.6×107 | 9.3×106 |
| I2+H2⇌2HI | 43 | 34 |
(1)仅依据K的变化可推断出随着卤素原子核电荷数的增加 (填字母)
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
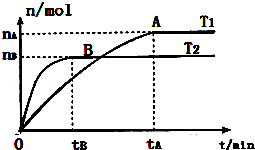
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=
②分析图象,下列说法正确的是 (填序号)
a.平衡常数K随温度的升高而变小
b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L﹣1HF溶液,下列各量中增大的是 (填序号)
a.c(H+) b.HF的电离常数 c.c(F﹣)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L﹣1AgNO3溶液的试管中滴加0.1mol•L﹣1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L﹣1KI溶液,出现了黄色沉淀.请简要解释此现象的原因: .
-
在温度t1和t2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (t1 ) | K (t2) |
|   2 2
| 1.8  | 
|
|   
| 
| 
|
|   
| 
| 
|
|   2HI 2HI
| 43 | 34 |
(1)已知t2 〉t1,HX的生成反应是________反应(填“吸热”或“放热”)。
(2)HX的电子式是________ 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________ 。
(4)X2都能与H2反应生成HX,用原子结构解释原因:________ 。
(5)K的变化体现出 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,平衡于 的转化率逐渐降低
的转化率逐渐降低
b.  与
与 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱
-
在一定温度(T)时,X2(g)和H2反应生成HX的平衡常数如下表。
| 化学方程式 | K(T) |
| F2+H2 2HF 2HF | 1.8×1036 |
| Cl2+H2 2HCl 2HCl | 9.7×1022 |
| Br2+H2 2HBr 2HBr | 5.6×107 |
| I2+H2 2HI 2HI | 43 |
(1)I 有多种同位素, 的中子数为______。
的中子数为______。
(2)用电子式表示HCl的形成过程______。
(3)下列说法正确的是______。
a 共价键的极性:HF>HCl
b 氯和溴氢化物性质的热稳定性:HCl>HBr
c 原子半径:S<Cl
d 酸性:H2SO4<HClO
(4)K的变化体现出X2化学性质的递变性,用原子结构解释X2得电子能力变化的原因______。
-
(14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:

请回答:
(1)该反应的化学平衡常数表达式为________。
(2)当温度T1>T2时,化学平衡常数K1________K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有________(写出一条合理措施即可)。
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是反应(填“放热”或“吸热”),判断依据是__________________。

(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为________。
-
乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:

请回答:
(1)该反应的化学平衡常数表达式为________。
(2)当温度T1>T2时,化学平衡常数K1________K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有________(写出一条合理措施即可)。
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是________反应(填“放热”或“吸热”),判断依据是__________________。

(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为________。
和
下,卤素X2(g)和H2反应生成HX的平衡常数如下表:








