-
下列各组反应,最终一定能得到白色沉淀的是
A.向Na2SiO3溶液中加入稀盐酸
B.向CuSO4溶液中加入NaOH溶液
C.向FeCl2溶液中加入过量NaOH溶液
D.向Al2(SO4)3溶液中加入过量NaOH溶液
难度: 简单查看答案及解析
-
食物的选择与其酸碱性关系很大。下列食物中,属于酸性食物的是
A.柠檬 B.黄瓜 C.萝卜 D.鸡蛋
难度: 简单查看答案及解析
-
下列物质中,属于弱电解质的是
A.CH3COOH B.H2SO4 C.NaOH D.Na2CO3
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是
A.蔗糖水 B.食盐水 C.豆浆 D.小苏打水
难度: 简单查看答案及解析
-
下列药品可用带玻璃塞的试剂瓶存放的是
A. 盐酸 B. 氢氟酸
C. NaOH溶液 D. Na2SiO3溶液
难度: 简单查看答案及解析
-
我国科技创新成果斐然,下列成果中获得诺贝尔奖的是
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.甲烷、乙烯和苯都可通过石油分馏得到
B.只用淀粉溶液即可检验食盐是否为加碘盐
C.利用油脂在碱性条件下的水解反应可以制肥皂
D.利用变性后可以再溶解的性质可分离提纯蛋白质
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.C2H4——乙烯的最简式
B.C2H6O——乙醇的结构简式
C.

D.
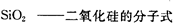
难度: 简单查看答案及解析
-
用饱和氯化铁溶液制取氢氧化铁胶体,正确的操作是
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,生成棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
D.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A.单质硅是重要的半导体材料
B.二氧化硅是制造光导纤维的材料
C.硅酸钠可以做木材防火剂
D.自然界里存在大量的单质硅和二氧化硅
难度: 简单查看答案及解析
-
已知:①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3判断下列物质的氧化能力由大到小的顺序是
A.Fe3+ > Cl2 > I2 B.Cl2 > Fe3+ > I2
C.I2 > Cl2 > Fe3+ D.Cl2 > I2 > Fe3+
难度: 中等查看答案及解析
-
某树脂的单体是丙烯酸钠(CH2=CHCOONa),关于丙烯酸钠的说法不正确的是
A.存在顺反异构
B.经加聚反应得树脂
C.水溶液呈碱性
D.使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
下列有关化学实验的叙述中,不正确的是
A.用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
B.重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤
C.制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物
D.实验室制取乙烯并验证其性质时,将产生的气体通入到NaOH溶液中除去杂质
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.1 mol 过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.金属钠投入水中: Na + H2O
Na+ + OH- + H2↑
B.铜加入稀硝酸中: 3Cu + 8H+ + 2NO3-
3Cu2+ + 2NO↑+ 4H2O
C.向AlCl3溶液中加入过量氨水: Al3+ + 4NH3• H2O
AlO2-+ 4NH4+ + 2H2O
D.澄清石灰水与过量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-
CaCO3↓+ H2O
难度: 中等查看答案及解析
-
在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法不正确的是
A.该反应属于取代反应
B.甲苯的沸点高于144℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
难度: 中等查看答案及解析
-
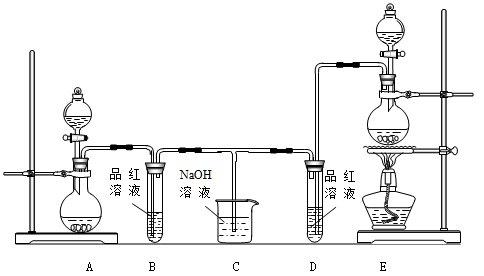
下图所示的实验装置或操作不能达到实验目的的是

难度: 中等查看答案及解析
-
从氧化还原角度分析,下列反应中水的作用相同的是
① Na和H2O ② NO2和H2O ③ Cl2和H2O ④ Na2O2和H2O
A.①②③ B.①②④ C.①③④ D.②③④
难度: 中等查看答案及解析
-
抗禽流感药物达菲可用莽草酸为原料来合成。莽草酸结构简式如图所示。下列说法正确的是
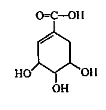
A.莽草酸的化学式为C7H6O5
B.1mol莽草酸最多能和4molNaOH发生反应
C.莽草酸分子中所有碳原子共平面
D.莽草酸在一定条件下可以发生取代、加成、消去、氧化反应
难度: 中等查看答案及解析
-
已知某强酸性溶液中存在较多的Ba2+、NO3-,则溶液中还可能大量存在的离子组是
A.K+、NH4+、HCO3- B.Na+、Cu2+、Cl-
C.Cu2+、Mg2+、SO42- D.Fe2+、Ca2+、Cl-
难度: 中等查看答案及解析
-
下列除杂过程中,所选用的试剂或方法不正确的是
A.Na2CO3固体中混有NaHCO3:充分加热固体混合物
B.FeCl2溶液中混有FeCl3:加入过量的铁粉,过滤
C.Fe2O3 固体中混有Al2O3:加入足量的盐酸,过滤
D.FeCl3溶液中混有FeCl2:通入足量的Cl2
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.只有醛类物质才能发生银镜反应
B.甲醛、乙醛、丙醛都没有同分异构体
C.将2%的稀氨水逐滴加入2% 的AgNO3溶液中,至沉淀恰好溶解为止,可制得银氨溶液
D.将2%的NaOH溶液4~6滴,滴入2 mL 10%的CuSO4溶液中制得Cu(OH)2悬浊液,用作检验醛基的试剂
难度: 中等查看答案及解析