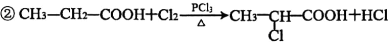-
化学已渗透到人类生产、生活的方方面面,下列说法正确的是( )
A.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
B.白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精
C.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径
D.泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出
B.用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中
C.用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低
D.溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待盛液润洗2~3次后方可使用
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素;其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外);W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
A.Y的简单离子半径小于Z的简单离子半径
B.Z的最高价氧化物对应水化物分别与X、Y最高价氧化物对应水化物反应生成1mol水时所放出的热量相同
C.Y的简单气态氢化物在一定条件下可被Q单质氧化
D.Q可分别与X、Y、Z、W形成化学键类型相同的化合物
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.银氨溶液可以用于区分麦芽糖和蔗糖
B.乙醇、乙二醇、丙三醇的沸点依次升高
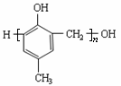
C.1mol乙酰水杨酸(
)最多可以和2molNaOH反应
D.可用
和HCHO为原料合成
难度: 中等查看答案及解析
-
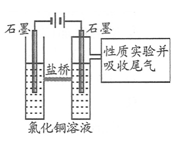
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
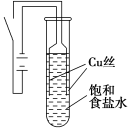
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质
氯化铜
氧化亚铜
氢氧化亚铜(不稳定)
氯化亚铜
颜色
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色
红色
橙黄色
白色
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
难度: 中等查看答案及解析
-
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol·L-1盐酸进行滴定,得到如下曲线。以下说法正确的是( )
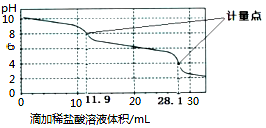
A.上一计量点前发生反应的离子方程式为HCO3-+H+==H2O+CO2↑
B.下一个计量点溶液中存在大量的阴离子是Cl-、HCO3-
C.此样品n(NaHCO3)=(28.1-2×11.9)×10-4mol
D.使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,将会得到1个计量点
难度: 中等查看答案及解析
-
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是( )
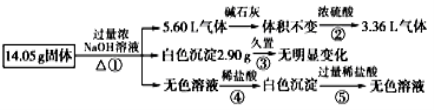
A.一定含有Al,其质量为4.5g
B.一定不含FeCl2,可能含有MgCl2和AlCl3
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4和MgCl2,且物质的量相等
难度: 中等查看答案及解析