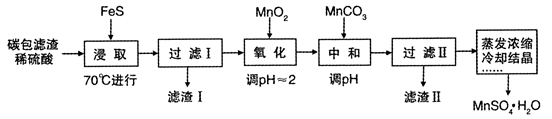
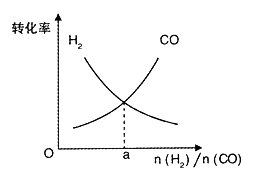
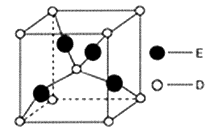
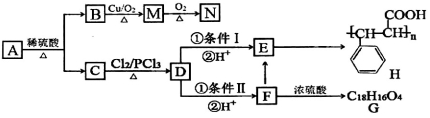
-
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法错误的是( )
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料
C. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
D. 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷 B. 乙烯、苯都能发生加成反应
C. 乙烯、聚氯乙烯分子中都含有碳碳双键 D. 淀粉、油脂、蛋白质都属于高分子化合物
难度: 中等查看答案及解析
-
短周期主族元素甲、乙、丙、丁、戊的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,在中学常见的酸中戊的最髙价氧化物对应的水化物的酸性最强。下列叙述错误的是( )
A. 氧元素与甲、乙、丙形成的二元化合物均只有两种
B. 简单离子半径:戊 >乙>丙>丁
C. 甲、乙、戊三种元素可形成含有共价键的离子化合物
D. 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,1.12L CCl4含有的共价键数为0.2NA
B. 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C. 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA
D. 常温下,0.1mol·L-1溶液中阴离子总数大于0.1NA
难度: 中等查看答案及解析
-
分子式为C7H6Cl2的芳香族化合物共有(不含立体异构体)( )
A. 6种 B. 9种 C. 10 种 D. 12 种
难度: 困难查看答案及解析
-
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
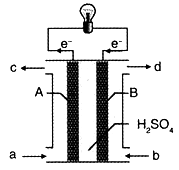
A. A为正极
B. 电池工作时H+由A极向B极迁移
C. 从b 口通入四氧化二氮气体且在B极发生氧化反应
D. A极发生的电极反应式:C2H8N2+4H2O+16e-=2CO2+N2+16H+
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液
加入H2O2后溶液变
成血红色
Fe2+既有氧化性
又有还原性
B
常温下将铜片放入浓硫酸中
生成刺激性气味的气体
反应生成了SO2
C
室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液
出现白色沉淀
Ksp(BaSO4)<Ksp(CaSO4)
D
向Ba(NO3)2溶液中通入SO2气体
有白色沉淀生成
沉淀是BaSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析