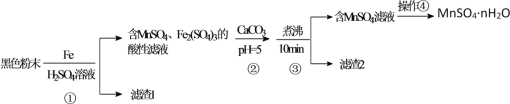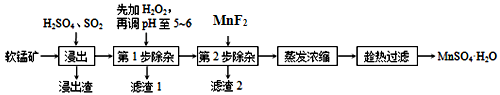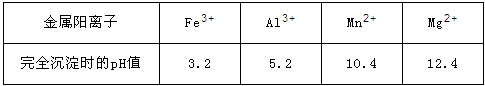-
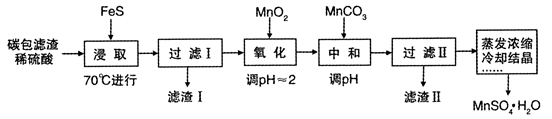
利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4 • H2O 的实验流程如下:
已知:25℃时,几种硫化物的溶度积常数如下:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有______________。
(2)在加热条件下“浸取”,其原因是__________________;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为__________________________。
(3)滤渣I的成分为MnO2、C和____________(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/C(Fe2+)= ____________(填数值)。
(4)“氧化”时的离子方程式为____________;氧化时可用H2O2代替MnO2,H2O2的电子式为_______。
(5)中和时,应该调节溶液pH的范围到____________。
-
一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
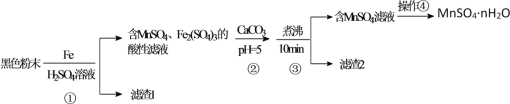
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
-
一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:

下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
-
一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:

下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
-
一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
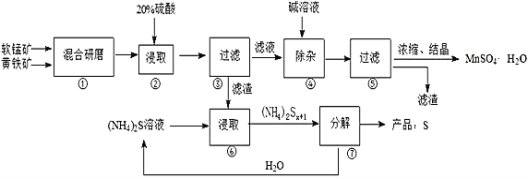
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是___________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为___________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入_________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4-5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90-100℃下进行,该反应的化学方程式________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
-
一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
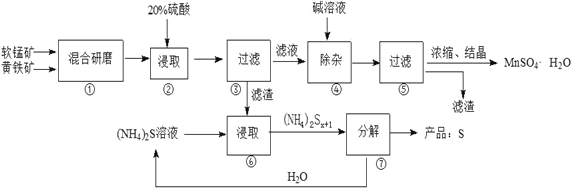
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
-
软锰矿的主要成分为MnO2,还含有MgO、CaO、FeO、Fe2O3、Al2O3等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
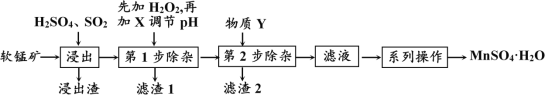
已知:① 几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
| 完全沉淀pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
② 温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)已知:25℃、101kpa时,
Mn(s)+O2(g)=MnO2(s) △ H=-520 kJ/mol
S(s)+O2(g)=SO2(g) △ H=-297 kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(aq) △ H=-1065 kJ/mol
“浸出”过程中MnO2转化为MnSO4的热化学方程式为___________________________。
(2) “第1步除杂”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)____________________________________________,需要调节的pH的范围是_________________;所加的试剂X是_________ (填以下物质序号)。
A、MnO2 B、MnCO3 C、KMnO4 D、NaOH。
请用平衡移动原理分析,加入X能使除去浸出液中Fe3+的原因是:_______________。
(3)根据下表数据,选择“第2步除杂”所加的物质Y(由一种阳离子和一种阴离子组成),物质Y的化学式____________。
| 阴离子 Ksp 阳离子 | CO32- | F- | OH- |
| Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
| Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
| Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
(4)采用“系列操作”中需要“趁热过滤”,其目的是_______________________________。
(5)以MnSO4溶液为原料,采用电解的方法可制备高纯度的MnO2,则电解池阳极的电极反应方程式为___________________________________________________________。
-
软锰矿的主要成分为MnO2,除含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
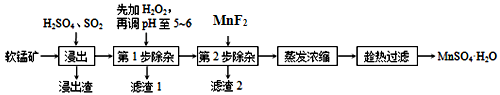
已知:①部分金属阳离子完全沉淀时的pH如下表:
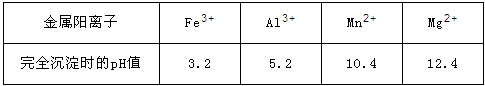
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2 转化为Mn2+的离子方程式为_____________。
(2)调pH至5~6的目的是___________,调pH至5~6所加的试剂可选择_________(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+ 、Mg2+ 转化为相应氟化物沉淀除去,写出MnF2 除去Mg2+ 的离子反应方程式_________,该反应的平衡常数数值为_________。
(已知:MnF2的KSP=5.3×10-3;CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是______(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为________。
-
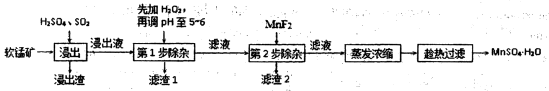
(18分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表

②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 ;
(2)第1步除杂中加入H2O2的目的是 。
(3)第1步除杂中形成滤渣l的主要成分为 (填化学式),调pH至5-6所加的试剂,
可选择 (填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式 ,该反应的平衡常数数值为 。
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是 。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为 。
-
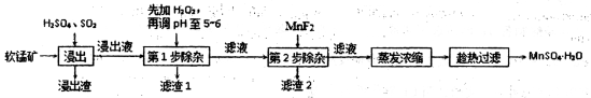
(18分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知①部分金属阳离子完全沉淀时的pH如下表
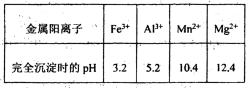
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 。
(2)第1步除杂中加入H2O2的目的是 。
(3)第1步除杂中形成滤渣l的主要成分为 (填化学式),调pH至5-6所加的试剂,可选择(填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式 ,该反应的平衡常数数值为 。
(已知:MnF2的Ksp(MnF2)= 5.3×10-3;CaF2的Ksp(CaF2)= 1.5×10-10;MgF2的Ksp(MgF2)=7.4×10-11)
(5)采用“趁热过滤”操作的原因是 。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为 。