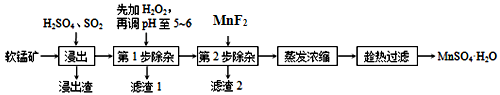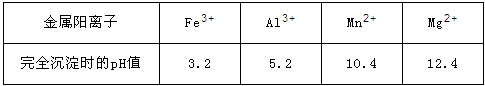-
软锰矿的主要成分为MnO2,除含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
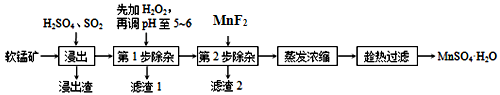
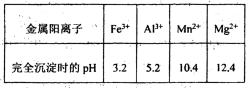
已知:①部分金属阳离子完全沉淀时的pH如下表:
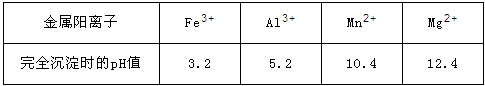
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2 转化为Mn2+的离子方程式为_____________。
(2)调pH至5~6的目的是___________,调pH至5~6所加的试剂可选择_________(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+ 、Mg2+ 转化为相应氟化物沉淀除去,写出MnF2 除去Mg2+ 的离子反应方程式_________,该反应的平衡常数数值为_________。
(已知:MnF2的KSP=5.3×10-3;CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是______(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为________。
-
(18分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
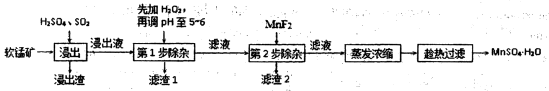
已知:①部分金属阳离子完全沉淀时的pH如下表

②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 ;
(2)第1步除杂中加入H2O2的目的是 。
(3)第1步除杂中形成滤渣l的主要成分为 (填化学式),调pH至5-6所加的试剂,
可选择 (填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式 ,该反应的平衡常数数值为 。
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是 。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为 。
-
(18分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
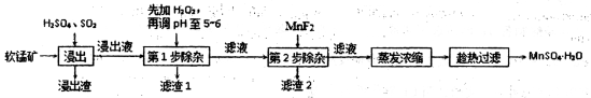
已知①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 。
(2)第1步除杂中加入H2O2的目的是 。
(3)第1步除杂中形成滤渣l的主要成分为 (填化学式),调pH至5-6所加的试剂,可选择(填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式 ,该反应的平衡常数数值为 。
(已知:MnF2的Ksp(MnF2)= 5.3×10-3;CaF2的Ksp(CaF2)= 1.5×10-10;MgF2的Ksp(MgF2)=7.4×10-11)
(5)采用“趁热过滤”操作的原因是 。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为 。
-
软锰矿的主要成分为MnO2,还含有MgO、CaO、FeO、Fe2O3、Al2O3等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
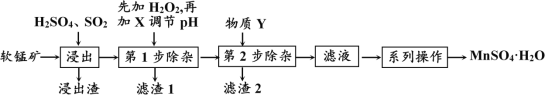
已知:① 几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
| 完全沉淀pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
② 温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)已知:25℃、101kpa时,
Mn(s)+O2(g)=MnO2(s) △ H=-520 kJ/mol
S(s)+O2(g)=SO2(g) △ H=-297 kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(aq) △ H=-1065 kJ/mol
“浸出”过程中MnO2转化为MnSO4的热化学方程式为___________________________。
(2) “第1步除杂”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)____________________________________________,需要调节的pH的范围是_________________;所加的试剂X是_________ (填以下物质序号)。
A、MnO2 B、MnCO3 C、KMnO4 D、NaOH。
请用平衡移动原理分析,加入X能使除去浸出液中Fe3+的原因是:_______________。
(3)根据下表数据,选择“第2步除杂”所加的物质Y(由一种阳离子和一种阴离子组成),物质Y的化学式____________。
| 阴离子 Ksp 阳离子 | CO32- | F- | OH- |
| Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
| Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
| Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
(4)采用“系列操作”中需要“趁热过滤”,其目的是_______________________________。
(5)以MnSO4溶液为原料,采用电解的方法可制备高纯度的MnO2,则电解池阳极的电极反应方程式为___________________________________________________________。
-
(16分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
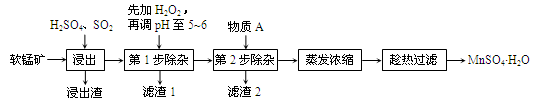
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
|  阴离子 阴离子
Ksp 阳离子 | CO32- | F- | OH- |
| Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
| Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
| Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
| Zn2+ | 1.2×10-10 | 3.0×10-2 | 6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
-
工业上用软锰矿(主要成分为MnO2,含有少量的SiO2和FeS2杂质)为原料制取高纯MnO2,其工艺流程如下:
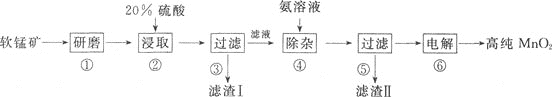
回答下列问题:
(1)步骤①将软锰矿研磨成细粉的主要目的是________;步骤②酸浸取时,主要产物有S、MnSO4及Fe2(SO4)3,写出反应的化学方程式:________。
(2)滤渣Ⅰ的主要成分是________。
(3)步骤④加入氨水调节pH=4,过滤后的滤液中,c(Fe3+)=________mol/L。{已知Ksp[Fe(OH)3]=1×10-38}
(4)步骤⑤所得的滤渣Ⅱ可用于制备铁红,该反应的化学方程式为________。
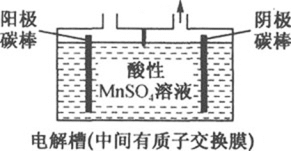
(5)步骤⑥电解MnSO4酸性溶液,原理如图所示。阳极产生MnO2,其电极反应式为________;阴极产生的气体为________(写化学式)。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
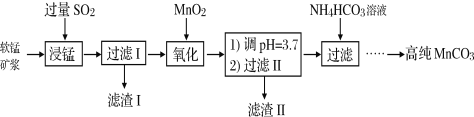
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
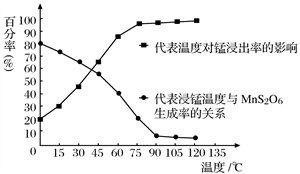
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
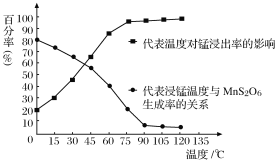
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
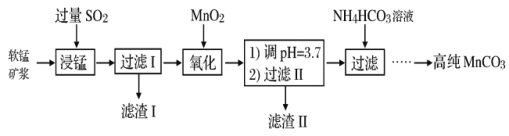
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+6H+=2Fe3++3H2O ii.……
写出ii的离子方程式:______________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___________(填离子符号)
(3)氧化过程中被MnO2氧化的物质有(写化学式):______________________。
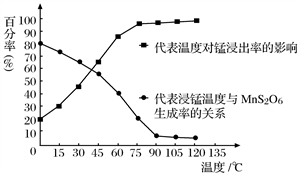
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
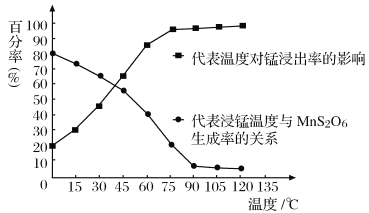
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:______________________。
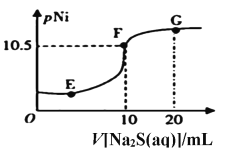
(6)已知:pNi=-lgc(Ni2+),常温下,Ksp(NiCO3)=1.4×10-7,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,会产生NiS沉淀,在滴加过程中pNi与Na2S溶液体积的关系如图所示。则在E、F、G三点中,___________点对应溶液中水电离程度最小,常温下,在NiS和NiCO3的浊液中 =______________________。
=______________________。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
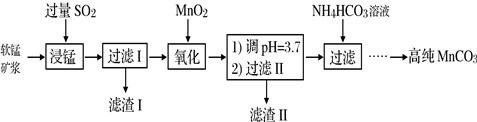
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
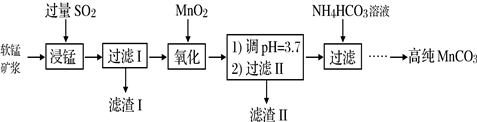
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。