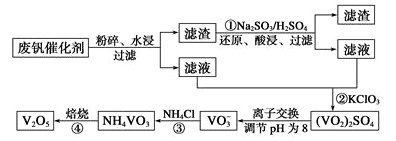
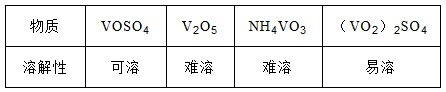
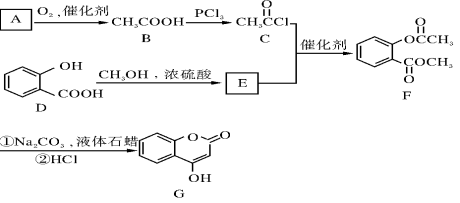
-
化学与生活密切相关,下列一些物质的用途或对环境的影响解释错误的是( )
选项
对环境的影响(或用途)
解释
A
酒精用于环境消毒
酒精能使蛋白质变性
B
热碳酸钠溶液清除炊具上残留的油污
碳酸钠溶液水解显碱性
C
SO2和NO2溶于水形成酸雨
SO2和NO2是酸性氧化物
D
浸泡过酸性KMnO4溶液的硅藻土保鲜水果
酸性KMnO4溶液氧化乙烯
难度: 简单查看答案及解析
-
下列对有机物的性质说法正确的是
A.乙苯和邻二甲苯属于同分异构体
B.苯和苯乙烯属于同系物
C.糖类和蛋白质都属于天
然高分子化合物
D.植物油和矿物油都属于油脂
难度: 简单查看答案及解析
-
下列试验中,所选装置不合理的是
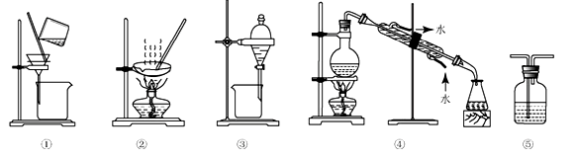
A. 粗盐提纯,选①和②
B. 用CC14提取碘水中的碘,选③
C. 用NaOH溶液吸收少量C12选⑤
D. 分离Na2CO3溶液和CH3COOC2H5,选④
难度: 简单查看答案及解析
-
下列说法中,不正确的是(设NA表示阿伏伽德罗常数)
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝
B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解
C.足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子
D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性
难度: 简单查看答案及解析
-
研究人员最近发现了一
种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是()
A.正极反应式:Ag+Cl--e-===AgCl
B.每生成1molNa2Mn5O10转移2mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
难度: 简单查看答案及解析
-
原子序数依次增大的a、b、c、d四种主族元素,其中a和d同族,a-的电子层结构与氦相同,b和c的次外层有8个电子,b2-、c-和d+的电子层结构相同。下列错误的是
A. 元素的非金属性次序为c>b>a
B. a-的还原性弱于c-的还原性
C. d和其他3种元素均能形成离子化合物
D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 简单查看答案及解析
-
常温下,下列说法正确的是
A.pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol·L-1
B.pH=a的氨水
溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a=b+1
C.pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①>②>③
难度: 简单查看答案及解析