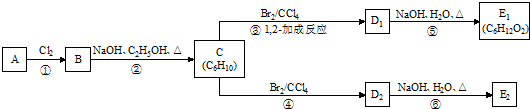
-
化学与生活密切相关,下列有关做法正确的是( )
A.为增强明矾净水效果,可同时加入氢氧化钡溶液
B.为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
C.为增强除油污效果,可使用热的纯碱溶液清洗
D.为防止植物油脂氧化,可将植物油脂露置于日光下难度: 中等查看答案及解析
-
科学家正在研究将汽车尾气中的NO和CO转变为CO2和N2,反应如下:
2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H=-373.4kJ•mol-1
一定条件下,在密闭容器中,反应达到平衡后,为提高该反应的反应速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时移出CO2难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.14 g氮气中含有7 NA个电子(NA代表阿伏加德罗常数)
B.HClO和CH2Cl2分子中的化学键都是极性共价键
C.第三周期元素的最高正化合价等于它所处的主族序数
D.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.在FeCl3溶液中加入Mg(OH)2固体,溶液中c(Fe3+)下降
B.CH3COOH溶液加水稀释后,恢复至原温度,溶液中c(OH-)和Kw都增大
C.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
D.常温下,向0.01 mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c (Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)难度: 中等查看答案及解析
-
下列实验或操作能达到预期目的是
①用溴水鉴别苯、乙醇、溴苯
②用盐酸酸化的硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④将碘水倒入分液漏斗,加入CCl4,振荡后静置,可将碘萃取到CCl4中
⑤在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸( )
A.①②③
B.①③④
C.②③④
D.②④⑤难度: 中等查看答案及解析
-
如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )
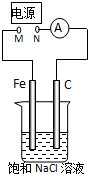
A.去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡
B.M连接电源正极,N连接电源负极,则Fe棒被保护不会溶解
C.M连接电源负极,N连接电源正极,当两极产生气体总量为 22.4mL(标准状况)时,则生成0.001mol NaOH
D.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀难度: 中等查看答案及解析