-
乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)在一定压强和温度下,在反应物总物质的量相同的情况下,测得该反应的实验数据如下表:
温度/℃CO2转化率/%
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①该反应是______反应(填“吸热”或“放热”).
②提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;化学平衡______移动,平衡常数K______(填“增大”、“减小”、或“不变”).
(3)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧气作用生成水和二氧化碳.该电池的负极反应式为:______.
若以上述燃料电池为电源来电解饱和食盐水,当消耗46g乙醇时,电解产生的H2体积(标况)为______L.
(4)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.
-
乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)请说明以CO2为原料合成乙醇的优点是______(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
温度/℃CO2转化率/%
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①该反应是______反应(填“吸热”或“放热”).
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;平衡常数K______.(填“增大”、“减小”、或“不变”)
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
______.
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.
-
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
-
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g)  CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=______.
(2)条件相同时,反应①与反应②相比,转化程度更大的是______;以CO2为原料合成乙醇的优点是______(写出一条即可).
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
| 温度/Kn(H2)/n(CO2)CO2转化率/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值______(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”).
(4)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:______.
-
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=______.
(2)条件相同时,反应①与反应②相比,转化程度更大的是______;以CO2为原料合成乙醇的优点是______(写出一条即可).
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值______(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”).
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:______.
-
乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
A.增大压强 B.加催化剂 C.增大CO2的浓度 D.及时分离体系中的乙醇
(3)利用CO合成乙醇是目前工业生产较为成熟的工艺。已知下列热化学方程式:
(iii)CO(g)+H2O(g)  CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
写出以CO(g)与H2(g)为原料合成乙醇的热化学方程式:___________________(焓变用 H1、
H1、 H3表示)。
H3表示)。
(4)反应(ii)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表:
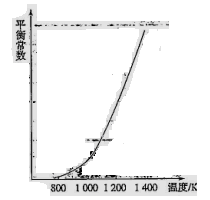
由此推知反应(ii)的焓变 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放。使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如下图所示:
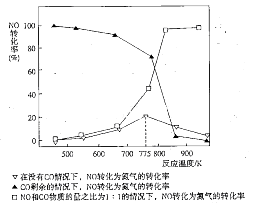
由图像可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是___________________________;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为__________________左右。
-
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1︰3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) △H<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1︰3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是

A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
-
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。
在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) 。
CH3CH2OH(g)+3H2O(g) 。
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
| 
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
温度升高,平衡常数K值将________(填“增大”、“减小”、或“不变”)。提高氢碳比[n(H2)/n(CO2)], 平衡常数K值将________(填“增大”、“减小”、或“不变”)。
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=________;
氢气的平衡浓度为________mol/L。
-
(14分)化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) △H=a kJ·mol-1
CH3CH2OH(g)+3H2O(g) △H=a kJ·mol-1
在一定压强下,测得上述反应的实验数据如下表。
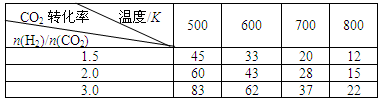
根据表中数据分析:
①上述反应的________0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即 )比,平衡常数K值________(填“增大”、“减小”、或“不变”),对生成乙醇________(填“有利”或“不利”)。
)比,平衡常数K值________(填“增大”、“减小”、或“不变”),对生成乙醇________(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
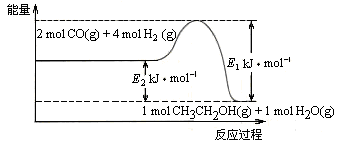
①写出CO和H2制备乙醇的热化学反应方程式________。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是________。
-
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)△H=- QkJ/mol(Q>0),在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
CH3CH2OH(g)+3H2O(g)△H=- QkJ/mol(Q>0),在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
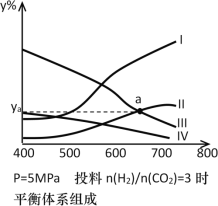
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号);在一定温度下反应达到平衡的标志是______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(2)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2 c.移去乙醇 d.增大容器体积
(3)图中曲线II和III的交点a对应物质的体积分数ya=_______%








