-
下列有关化学用语的表示正确的是
A. 医用“钡餐”的化学式:BaCO3
B. Cl-的结构示意图:
C. NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D. NH4Cl的电子式为
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 若将1mol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数目为NA
B. 1molCH3COONa 和少量CH3COOH溶于水所得中性溶液中CH3COO-的数目为NA
C. 标准状态下2.24 LCl2溶于水,转移的电子数目为0.1NA
D. 0.1mol NaHSO4晶体中含有H+ 数为0.1NA
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合产生沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O
B. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C. NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
NH3↑+H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
Fe3++3NO2↑+3H2O
难度: 困难查看答案及解析
-
利用实验器材(规格和数量不限,夹持装置省略),能完成相应实验的一项是
选项
实验器材(省略夹持装置)
相应实验
A
坩埚、玻璃棒、酒精灯、泥三角
CuSO4溶液的浓缩结晶
B
烧杯、玻璃棒、胶头滴管、滤纸
用盐酸除去BaSO4中的少量碳酸银
C
烧杯、玻璃棒、胶头滴管、容量瓶
用固体氯化钠配制0.5mol/L的溶液
D
烧杯、玻璃棒、胶头滴管、分液漏斗
用溴水和CCl4,除去NaBr溶液中少量NaI
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
二氧化氯 (ClO2)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+ →MnO2↓+Cl-(部分反应物和产物省略、未配平),下列有关该反应的说法正确的是
A. 工业上可用更为廉价的Cl2来代替ClO2
B. 利用该原理处理含Mn2+的污水后溶液的pH升高
C. 该反应中氧化产物和还原产物的物质的量之比为2:5
D. 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO2 8.96L
难度: 困难查看答案及解析
-
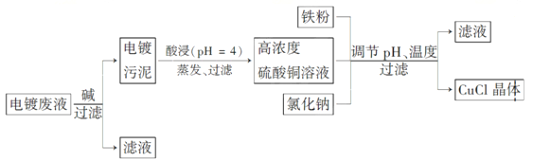
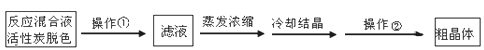
4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
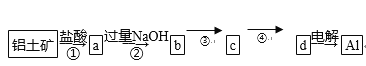
下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析
-
火法炼汞是在不太高的温度下(450-800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:
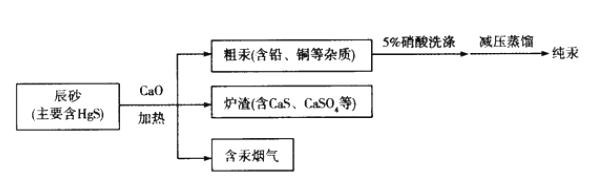
下列有关说法正确的是
A. 流程中加入氧化钙的目的是减少SO2的排放
B. “辰砂”加热时发生反应:HgS+O2
Hg+SO2,该方法属于热分解法
C. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
D. 含汞烟气中汞的含量很低,可以直接排放
难度: 中等查看答案及解析
-
向恒温,恒容(2L)的密闭容器中充入2mol SO2和一定量的O2发生反应:2SO2(g)+O2(g)
2SO3(g) ΔH=-197.74 kJ·mol-1,4 min后达到平衡,这时c(SO2)=0.2 mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
A. 2 min时,c(SO2)=0.6 mol·L-1
B. 用O2表示4 min内的反应速率为0.1 mol·(L·min)-1
C. 再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D. 4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A. 图1表示1LpH=2的CH3COOH溶液加水稀释至VL,pH随1gV的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1 <T2
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)⇌2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 困难查看答案及解析
-
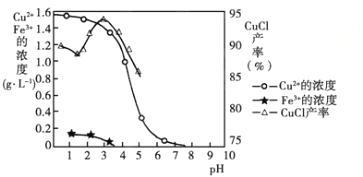
已知常温下Ksp(AgCl)=1.8×10-10mol2/L2,Ksp(AgI)=1.0×10-16 mol2/L2。下列说法中正确的是
A. 在相同温度下AgCl的溶解度小于AgI的溶解度
B. AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C. 常温下,AgC1若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11mol/L
D. 将足量的AgCl分别放入下列物质中:①20mL0.01mol/LKCl溶液 ②10mL0.02mol/LCaCl2溶液 ③30mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的顺序为: ③>②>①
难度: 困难查看答案及解析
-
已知草酸为二元弱酸:
H2C2O4
HC2O
+H+ Ka1
HC2O
C2O
+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O
、C2O
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
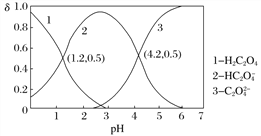
A. pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4)
B. pH=2.7的溶液中:
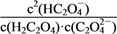 =1 000
=1 000C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
难度: 困难查看答案及解析
-
膜技术原理在化工生产中有着广泛的应用,有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。下列说法不正确的是
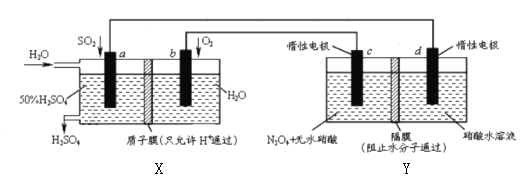
A. X是原电池,能够生产硫酸;Y是电解池,能够生产N2O5
B. C电极的电极反应方程式为N2O4+2HNO3-2e-=2N2O5+2H+
C. 当电路中通过2mole,X、Y中各有2molH+从左边迁移到右边
D. 电路中电子流向为a
d
c
b
a形成闭合回路
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中一种为金属元素。m、n、p、q、r、s是由这些元素组成的二元或三元化合物,t是元素Y的常见单质,m 是一种具有特殊颜色的气体,p 可作漂白剂、供氧剂。上述物质的转化关系如图所示。下列说法中不正确的( )
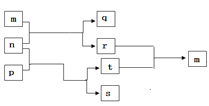
A. 四种元素简单离子半径:X〉Y〉Z〉W
B. p、s中的化学键类型完全相同
C. X、Y的简单氢化物的沸点:Y〉X
D. 常温下,0.01mol/L q溶液的pH为2
难度: 中等查看答案及解析