-
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.盐酸滴定氨水,可以选择酚酞为指示剂
B.电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3
C.分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液
D.若要使Na2S溶液中c(Na+)/c(S2-)的值减小,可以加入适量的KOH固体
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
B.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
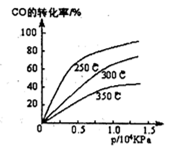
下列表示正确的是( )
A.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O =2HCO3-+SO32-
B. CO(g)的燃烧热是283.0kJ·
,则
反应的
C. 含有大量
的溶液中:K+、
、
、
可共存
D. 在某钠盐溶液中含有等物质的量的
、
、
、
、
、
中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有
难度: 困难查看答案及解析
-
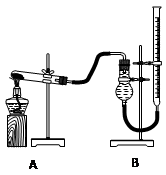
下列有关实验的叙述正确的是( )。
A.可用碱式滴定管量取12.85 mL的KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置
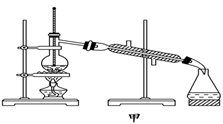
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示
难度: 中等查看答案及解析
-
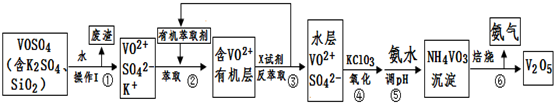
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列 有关说法中不正确的是( )
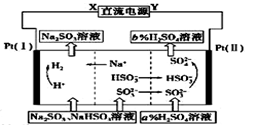
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.01mol/L的Na2HPO4溶液中存在如下的平衡:HPO42-
H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)
C.常温下,0.01mol/L的 HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混和后,所得溶液的pH≦7
D.在NH4HSO3溶液中,c(NH4+)= c(SO32-)+ c(HSO3-)+ c(H2SO3)
难度: 困难查看答案及解析
-
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气一定为0.3 mol
B.反应后的溶液中n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1
难度: 中等查看答案及解析