-
对发现元素周期律贡献最大的化学家是
A.牛顿 B.道尔顿 C.阿佛加德罗 D.门捷列夫
难度: 简单查看答案及解析
-
下列气体中,主要成分不是甲烷的是
A.天然气 B.水煤气 C.坑气 D.沼气
难度: 简单查看答案及解析
-
下列物质中,有共价键的单质是
A.N2 B.CH4 C.NaCl D.MgCl2
难度: 简单查看答案及解析
-
某种建筑材料含有一种对人体有害的放射性核素氡(
Rn),该原子核内的中子数是
A.50 B.86 C.136 D.222
难度: 简单查看答案及解析
-
化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是
A.天然气燃烧
B.中和反应
C.冰的融化
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的充分反应
难度: 简单查看答案及解析
-
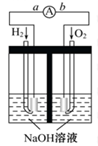
如右图所示装置,若要使装置中电流计的指针发生偏转,则向容器中加入的物质是
A.植物油 B.酒精 C.蔗糖溶液 D.稀硫酸
难度: 简单查看答案及解析
-
不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
难度: 简单查看答案及解析
-
短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物熔点比B的氧化物高
D.A与C可形成离子化合物
难度: 简单查看答案及解析
-
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+ 、bBn+ 、cC(n+1)- 、dDn- 均具有相同的电子层结构,则下列叙述正确的是
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn-
D.单质还原性:B>A,单质氧化性:D>C
难度: 简单查看答案及解析
-
假设原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2个。如果按此规律排布周期表,那么该周期表第3、4、5周期含有的元素分别有
A.5种,10种,15种 B.8种,18种,18种
C.8种,10种,15种 D.9种,12种,15种
难度: 简单查看答案及解析
-
下列叙述中,错误的是
A.原子半径:Na>Mg>O
B.13C和14C属于同位素
C.0族元素是同周期中非金属性最强的元素
D.N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法中错误的是
A.反应速率用于衡量化学反应进行快慢
B.决定化学反应速率的主要因素是反应物的本质
C.可逆反应达到平衡状态时正逆反应的速率都为0
D.增大反应物的浓度,提高反应温度都能增大反应速率
难度: 简单查看答案及解析
-
A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的
A.A和B元素一定都是第2周期元素 B.A和B元素一定是同一主族元素
C.B元素可以是第2周期VIA族元素 D.可以相互化合形成化合物
难度: 简单查看答案及解析
-
一定温度下,可逆反应N2+3H2
2 NH3达到平衡的标志是
A. N2、H2 、NH3浓度相等
B.N2,H2,NH3分子数之比为1:3:2
C.单位时间内生成nmolN2同时生成2nmolNH3
D.单位时间内生成nmolN2同时生成3nmolH2
难度: 简单查看答案及解析
-
下列说法正确的是
A.氯化氢溶于水能电离出H+ 和 CI-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧是同分异构体
D.有机物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体
难度: 简单查看答案及解析
-
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
难度: 简单查看答案及解析
-
可逆反应 2A (气) + 3B (气)
2C (气) + D(气),在四种不同条件下反应速率最快的是
A.VA = 0.5mol/(L·min) B.VB = 0.6mol/(L·min)
C.VC = 0.35mol/(L·min) D.VD = 0.4mol/(L·min)
难度: 简单查看答案及解析
-
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-,下列叙述不正确的是
A.H2通入负极区 B.O2通入正极
C.正极发生氧化反应 D.负极反应为2H2 + 4OH- - 4e- = 4H2O
难度: 简单查看答案及解析
-
某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
A.R一定是第四周期元素
B.R的气态氢化物比同周期其他元素气态氢化物稳定
C.R一定是ⅣA族元素
D.R气态氢化物化学式为H2R
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.元素非金属性按X、Y、Z的顺序减弱
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.单质的氧化性按X、Y、Z的顺序增强
难度: 简单查看答案及解析
-
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
难度: 简单查看答案及解析
-
电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性由强到弱顺序为:HXO4>H2YO4>H3ZO4,下列判断错误的是
A.原子半径 X>Y>Z B.气态氢化物稳定性X>Y>Z
C.元素原子得电子能力X>Y>Z D.单质与氢气反应难易X>Y>Z
难度: 简单查看答案及解析
-
对于以下反应:A(s)+3B(g)
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
难度: 简单查看答案及解析
-
某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 简单查看答案及解析
-
在反应5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应和发生还原反应的氮原子个数比是
A、5:8 B、3:5 C、5:4 D、5:3
难度: 简单查看答案及解析