-
小亮对妈妈杀鱼时从鱼肚内取出的鱼鳔产生了兴趣,他准备探究“鳔内气体的体积和成分”。他通过查阅资料获知:鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气。探究分两步进行:
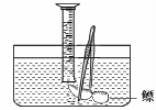
(1)测量鱼鳔内气体的体积。小亮设计了两种方法: A、用医用注射器抽取鳔内气体,测量其体积;B、在水下剌破鳔,用排水法收集鳔内气体并测量其体积(如下图)。你认为这两种方法中不合理的是________,理由:_________________________________。
(2)探究鱼鳔内气体的成分。给你两集气瓶鳔内气体,请你帮助他设计实验方案。
| 实验步骤 | 实验现象 |
| 验证鳔内含有氧气 | ①________________ | ②______________________ |
| 验证鳔内含有二氧化碳 | ③_____________________ | ④____________________ |
-
某校化学兴趣小组的同学按照图1做“测定空气里氧气的含量”实验。他们将燃烧匙内的红磷点燃后,立即伸入集气瓶中塞紧橡皮塞,待红磷熄灭冷却后,打开弹簧夹,发现气体减少的体积小于1/5。这是什么原因呢?同学们就该现象做了如下探究:
【提出问题】 造成这个结果的原因是什么?如何改进?
【猜想与假设】 排除了属于偶然因素后,其中三位同学对原因做了如下猜想:
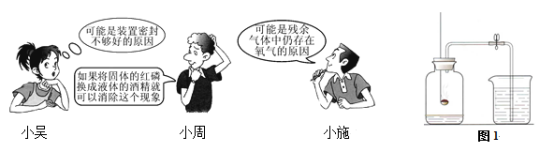
(1)对于这一现象的原因,你还能做出怎样的猜想?请写出:_______________________。
【分析与交流】
(2)对小周的猜想,大家一致认为不合理,原因是:_______________________________。
【反思与评价】
(3)小明将红磷换成了足量的镁条进行燃烧实验,结果待镁条熄灭冷却后,打开弹簧夹,烧杯中的水回流,几乎占满了集气瓶,由此得到的结论是:___________________________。
【实验改进】有资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测得结果与理论值误差较大。小亮根据铁在空气中生锈的原理设计下图实验装置,再次测定空气中氧气含量,装置中饱和食盐水、活性炭会加速铁生锈,测得实验数据如下表。
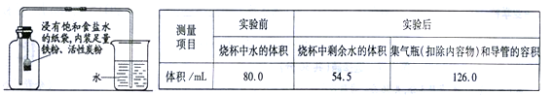
(4)根据表4数据计算,改进实验后测得的空气中氧气的体积分数是_________(计算结果精确到0.1%)。
(5)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:
①_______________________________________________________________;
②_______________________________________________________________。
-
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出化学反应的文字表达式:________________________________________________。
小芳发现,氯酸钾与氧化铜混合加热,也能较快地产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO (质量比l:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
【分析数据、得出结论】
(1)由实验_________________与实验④对比,证明猜想合理。
(2)实验所用的三种金属氧化物,催化效果最好的是___________________。
【反思】
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和____________不改变。
(2)同种催化剂,颗粒大小可能影响催化效果,请你设计实验方案进行验证:
________________________________________________________________________;
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究 (探究一种因素即可)。
①你的假设:_______________________________________;
②你的实验方案:______________________________________________________________。