-
我国稀土资源丰富。下列有关稀土元素
Sm与
Sm的说法正确的是
A.
Sm与
Sm互为同位素 B.
Sm与
Sm的化学性质不同
C.
Sm与
Sm是同一种核素 D.
Sm与
Sm的核外电子数和中子数均为62
难度: 简单查看答案及解析
-
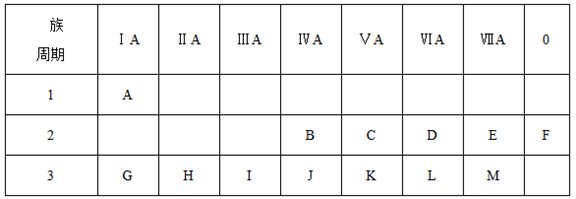
原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )。
A. ①④ B. ②③ C. ②④ D. ①⑤
难度: 中等查看答案及解析
-
已知碳有三种常见的同位素:12C、13C、14C,氧也有三种同位素:16O、17O、18O,由这六种原子构成的二氧化碳分子最多有
A. 18种 B. 6种 C. 9种 D. 12种
难度: 困难查看答案及解析
-
甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x+2 B. x+4
C. x+8 D. x+18
难度: 中等查看答案及解析
-
原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
A. 同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大
B. 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置
C. 由氟、氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸
D. 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料
难度: 困难查看答案及解析
-
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素。下面关于它的原子结构和性质预测正确的是
A. 类铅元素原子的最外层电子数为4 B. 其常见价态为+2、+3、+4
C. 它的金属性比铅弱 D. 它的原子半径比铅小
难度: 中等查看答案及解析
-
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
A. 元素原子的最外层电子数等于元素的最高化合价
B. 多电子原子中,在离核较近的区域内运动的电子能量较高
C. P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
难度: 中等查看答案及解析
-
下列说
法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第IA族元素,Cs失电子能力比Na强
D.P和As属于第VA族元素,H3PO4酸性比H3AsO4弱
难度: 简单查看答案及解析
-
以下有关原子结构及元素周期律的叙述正确的是
A. 第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B. 同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C. 第ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D. 同主族元素从上到下,单质的熔点逐渐降低
难度: 中等查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是
A. H3BO3的酸性比H2CO3的强
B. Mg(OH)2的碱性比Be(OH)2的强
C. HCl、HBr、HI的热稳定性依次增强
D. 若M+和R2-的核外电子层结构相同,则原子序数:R>M
难度: 中等查看答案及解析
-
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A. 单质的化学活泼性:W<X<Y<Z
B. 原子最外层电子数:W<X<Y<Z
C. 单质的氧化能力:W<X<Y<Z
D. 元素的最高化合价:W<X<Y<Z
难度: 中等查看答案及解析
-
下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素化学性质几乎完全相同
难度: 中等查看答案及解析
-
下列说法正确的是
A. 第2周期元素从左到右,最高正化合价从+1递增到+7
B. 在周期表中的过渡元素中寻找半导体材料
C. 元素周期表中元素的性质与元素在周期表中的位置有关
D. 同种元素的原子均有相同的质子数和中子数
难度: 简单查看答案及解析
-
下列说法不正确的是
A. I的原子半径大于Br,HI比HBr的热稳定性强
B. P的非金属性强于Si,H3PO4比H4SiO4的酸性强
C. 原子半径Na>Mg
D. 同主族元素的简单阴离子还原性从上到下依次增强
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D.
Cl 与
Cl 得电子能力相同
难度: 中等查看答案及解析
-
下列结论正确的是
①微粒半径:S2->Cl->F
②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>S>Se
A. ①②④⑥ B. ①③④ C. ①③ D. ⑤⑥
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A. C、N、O元素的单质与氢气化合越来越难
B. Li、Na、K的氧化物的水化物的碱性依次减弱
C. Na、Mg、Al的简单离子的氧化性以依次增强
D. P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱
难度: 简单查看答案及解析
-
某元素X的气态氢化物的化学式为XH3,则下列叙述中不正确的是
A. 该元素原子的最外电子层上有5个电子
B. 该元素最高价氧化物的化学式为X2O5
C. 该元素在元素周期表中位于VA族
D. 该元素最高价氧化物对应的水化物的化学式为H2XO3
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
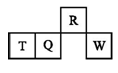
A. 最简单气态氢化物的热稳定性R>Q
B. 最高价氧化物对应水化物的酸性Q<W
C. 离子半径R>T
D. 含T的盐中,T元素只能存在于阳离子中
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述中正确的是
A. 元素X的简单气态氢化物的热稳定性比W的强
B. 元素W的最高价氧化物对应水化物的酸性比Z的弱
C. 化合物YX、ZX2、WX3中化学键的类型相同
D. 原子半径的大小顺序:rY>rZ>rW>rX
难度: 困难查看答案及解析
-
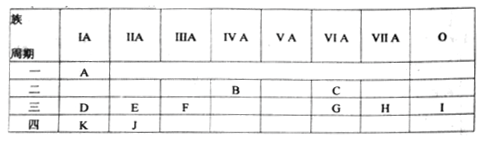
下表是元素周期表的一部分,有关说法正确的是
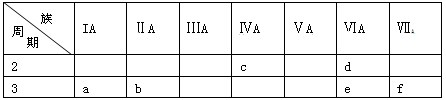
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
难度: 中等查看答案及解析
-
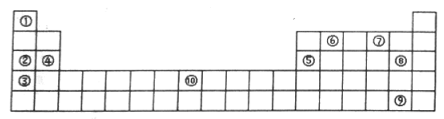
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是
A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>己
C. 丙与庚的原子核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
难度: 困难查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A. X、Y元素的金属性X<Y
B. 一定条件下,Z单质与W的常见单质直接形成ZW2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
A. 最简单气态氢化物的热稳定性Y>X>W>Z
B. 最高价氧化物对应水化物的酸性X>W>Z
C. 原子半径:W>Z>Y>X
D. 元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示,下列说法正确的是
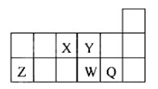
A. 离子Y2-和Z3+的核外电子数和电子层数都不相同
B. 原子半径的大小顺序为rX>rY>rZ>rW>rQ
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 中等查看答案及解析