-
下列说法正确的是
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
难度: 简单查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s)
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
难度: 中等查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:
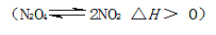
(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
难度: 中等查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)
2Z(g)+W(s),该反应的ΔH<0,下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
在恒温时,一固定容积的容器内发生如下反应:2NO2(g)
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
难度: 中等查看答案及解析
-
反应PCl5(g)
PCl 3(g)+Cl2(g) ① 2HI(g)
H2(g)+I2(g) ②
2NO2(g)
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变 B.均增大 C.①增大,②不变,③减少 D.①减少,②不变,③增大
难度: 中等查看答案及解析
-
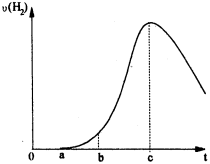
N2O5是一种新型硝化剂。其性质和制备受到人们的关注。一定温度下,在2L固定容积的密闭容器中发生反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是 ( )
A.20s内平均反应速率V(N2O5)=0.1mol·(L·s)-1
B.10s时,正逆反应速率相等,达到平衡
C.20s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
难度: 中等查看答案及解析
-
强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3KJ/mol
已知CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1KJ/mol
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH=-Q2KJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH=-Q3KJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
难度: 中等查看答案及解析
-
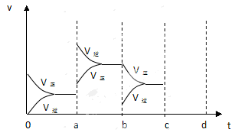
已知:2M(g)
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )

A. a、b、c、d四个点中处于平衡状态的点是a、b d
B. 反应进行至25min时,曲线发生变化的原因是加入了 0.4molN
C. 若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
D. 若40min后出现如图所示变化,则可能是加入了某种催化剂
难度: 中等查看答案及解析
-
在体积固定的密闭容器中进行可逆反应2NO2
2NO+O2,下列能作为反应达到平衡状态标志的是( )
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g) △H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A.2a2=a1=197 kJ B.197 kJ> a1=2a2 C.a2>a1>197 kJ D.2a2<a1<197 kJ
难度: 中等查看答案及解析
-
根据下列热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.ΔH=+244.1kJ/mol B.ΔH=-488.3kJ/mol
C.ΔH=-996.6kJ/mol D.ΔH=+996.6kJ/mol
难度: 中等查看答案及解析
-
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z 的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )
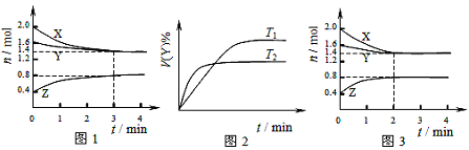
A.容器中发生的反应可表示为:3X(g)+Y(g)
2Z(g)
B.图1 反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L·min)
C.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
难度: 中等查看答案及解析
-
在密闭容器中的一定量的混合气体发生如下反应:aA(g)+bB(g)
cC(g)+dD (g)
平衡时测得A的浓度为0.5mol/L,保持温度不变,将体积压缩为原来的1/2,在达到平衡时,测得A的浓度为0.8mol/L,则下列说法正确的是: ( )
A .a+b<c+d B.平衡正向移动 C.B的转化率降低 D .C的体积分数降低
难度: 中等查看答案及解析