-
(12分)氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。
-
(12分)氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)  2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)若恒容下升高温度,则混合气体的相对分子质量 ;密度 。(填“变大”“变小”或“不变”)。
(3)若充入氩气,并保持压强不变,平衡将 ;(填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热, 加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
-
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
-
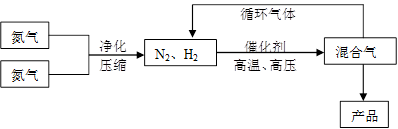
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到________℃使混合气体分离出来产品;继续循环的气体是________。
(2)工业上采取用上述(1)操作的目的:________
________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
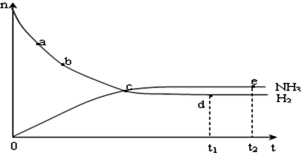
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
-
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
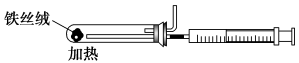
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
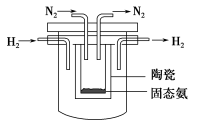
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
-
(题文)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
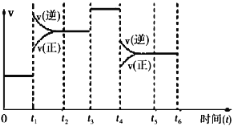
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________,t3_____________________,t4_____________________。
(2)下列时间段中,氨的百分含量最高的是(_______)
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g) 2NH3(g) ΔH= - 92.4 kJ·mol-1.
2NH3(g) ΔH= - 92.4 kJ·mol-1.
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ(填“小于”,“大于”或“等于”)。
(2)当反应达到平衡时,N2和H2的浓度比是_________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
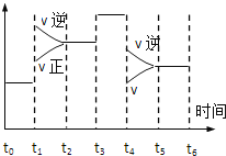
(1)t1时刻,体系中发生变化的条件是_______ 。
A.增大压强B.升高温度C.减小压强D.降低温度 E.加入正催化剂
(2)下列时间段中,氨的百分含量最高的是_______。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是_____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将______ (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”“小于”或“等于”)原来的2倍。
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
(1)在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
①当反应达到平衡时,N2和H2的浓度比是__________
②升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不”)移动。
④若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(2)该反应 N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
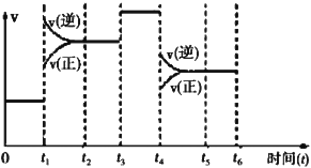
①t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1______________,t3_____________,t4___________。
②下列时间段中,氨的百分含量最高的是______
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应;
(1)测得反应放出的热量_____92.4kJ (填“小于”,“大于”或“等于”)
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_____。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将__________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)⇌2NH3(g) △H=﹣92.4kJ/mol 在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
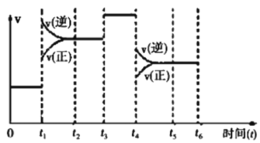
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1__________,t3__________,t4__________。
(2)下列时间段中,氨的百分含量最高的是_______
A.0~t1B.t2~t3 C.t3~t4D.t4~t5
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应)







