-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I. 该反应 N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
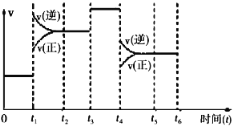
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1___________,t3____________,t4__________。
(2)下列时间段中,氨的百分含量最高的是__________
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
II. 在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(2)缩小体积增大压强,混合气体的平均相对分子质量________ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持总压强不变,平衡将___________(填“正向”、“逆向”或“不移动”)。
(4)已知合成氨的反应在298K时:正反应的△H=-92.4kJ/mol,△S=-0.1982kJ/(mol·K),根据焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(5)若容器恒容、绝热,该反应达到平衡的标志是___________
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V正(N2) =V正(NH3)
⑦单位时间内3mol H-H断裂同时2mol N-H也断裂.
-
(12分)氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)  2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)若恒容下升高温度,则混合气体的相对分子质量 ;密度 。(填“变大”“变小”或“不变”)。
(3)若充入氩气,并保持压强不变,平衡将 ;(填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热, 加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
-
(题文)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
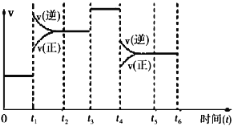
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________,t3_____________________,t4_____________________。
(2)下列时间段中,氨的百分含量最高的是(_______)
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g) 2NH3(g) ΔH= - 92.4 kJ·mol-1.
2NH3(g) ΔH= - 92.4 kJ·mol-1.
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ(填“小于”,“大于”或“等于”)。
(2)当反应达到平衡时,N2和H2的浓度比是_________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
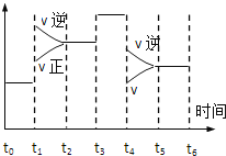
(1)t1时刻,体系中发生变化的条件是_______ 。
A.增大压强B.升高温度C.减小压强D.降低温度 E.加入正催化剂
(2)下列时间段中,氨的百分含量最高的是_______。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是_____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将______ (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”“小于”或“等于”)原来的2倍。
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
(1)在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
①当反应达到平衡时,N2和H2的浓度比是__________
②升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不”)移动。
④若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(2)该反应 N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
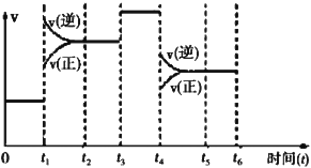
①t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1______________,t3_____________,t4___________。
②下列时间段中,氨的百分含量最高的是______
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应;
(1)测得反应放出的热量_____92.4kJ (填“小于”,“大于”或“等于”)
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_____。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将__________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)⇌2NH3(g) △H=﹣92.4kJ/mol 在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
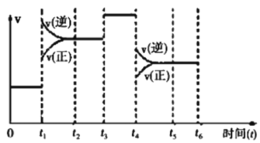
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1__________,t3__________,t4__________。
(2)下列时间段中,氨的百分含量最高的是_______
A.0~t1B.t2~t3 C.t3~t4D.t4~t5
-
(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
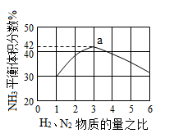
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
-
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
-
(12分)氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。
2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。





