-
下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末
B.除去CO2中的少量HCl:通入Na2CO3溶液
C.除去KCl溶液中的少量K2CO3:加入适量的盐酸
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期元素,已知X、Z同主族,Y2+、Z-、W+ 三种离子的电子层结构与氖原子相同,下列排序正确的是
A. 碱性:Y(OH)2>WOH B. 阴离子的还原性:X->Z-
C. 原子半径:W>Y>Z>X D. 气态氢化物的稳定性:HX>HZ
难度: 中等查看答案及解析
-
下列物质敞口放置不会对空气造成污染的是
A.食盐 B.浓盐酸 C.苯 D.浓硝酸
难度: 简单查看答案及解析
-
在强碱溶液中,下列各组离子能够大量共存的是
A.Mg2+ 、Ca2+ 、HCO3― 、Cl― B.Na+ 、Al3+ 、ClO― 、SO42―
C.K+ 、Fe2+ 、SO42― 、Br― D.ClO― 、K+ 、Cl― 、SO42―
难度: 简单查看答案及解析
-
乳酸在一定条件下所形成的聚酯的结构简式为
,该酯可以作为新型的餐具原料。由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解。下列有关这种新型的可降解塑料的叙述正确的是( )
A.降解塑料是一种纯净物
B.其生产过程中的聚合方式与聚苯乙烯相似
C.它属于一种线型高分子材料
D.其相对分子质量为72
难度: 简单查看答案及解析
-
下列单质或化合物性质的描述正确的是
A.食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.SiO2与酸、碱均能反应,属于两性氧化物
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
实验室制取下列气体,其反应放热的是( )
A.氯化铵和氢氧化钙制氨气 B.由乙醇制C2H4
C.由电石制C2H2 D.由氯酸钾制O2
难度: 中等查看答案及解析
-
下图表示某高分子化合物的结构片断。关于该高分子化合物的推断正确的是( )
A.3种单体通过加聚反应聚合
B.形成该化合物的单体只有2种
C.其中一种单体为
D.其中一种单体为1,5-二甲基苯酚
难度: 中等查看答案及解析
-
下列各组离子中,一定能大量共存的是 ( )
A.加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+
B.滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN-
C.在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3-
D.在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3-
难度: 中等查看答案及解析
-
下列物质中所含分子物质的量最多的是
A.56gN2 B.1.5molO2
C.标准状态下22.4LCl2 D.3.01×1023个硫酸分子
难度: 中等查看答案及解析
-
25℃,两种酸的电离常数如下表。
Ka1
Ka2
H2A
1.3×10-2
6.3×10-6
H2B
4.2×10-7
5.6×10-7
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为:
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
难度: 中等查看答案及解析
-
下列化学用语和描述均正确的是
A.空气中电子式为
的分子含量过多会造成温室效应
B.结构示意图为
的阴离子都不能破坏水的电离平衡
C.球棍模型为
的分子可发生加成反应
D.电子式分别为
和
的两种化合物均为常见的氧化剂
难度: 中等查看答案及解析
-
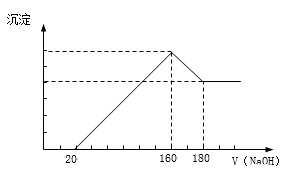
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Na2SO4溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH溶液
HCl溶液
难度: 简单查看答案及解析
-
限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:2H++SO32-→H2O+SO2↑的化学反应个数有
A.4 B.5 C.8 D.12
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A.1.01×105Pa,20℃时48g O3含有的分子数为NA
B.1molNa2O2晶体中阴离子数为2 NA
C.标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA
难度: 中等查看答案及解析
-
下列物质中均既有离子键又有共价键的一组是
A.NaOH、H2O、NH4Cl B.KOH、Na2O2、NH4Cl
C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2
难度: 中等查看答案及解析
-
下列说法不正确的是
A.使元素的化合态转化成游离态的过程可能是还原的过程
B.高炉炼铁的原料有铁矿石、焦炭和空气。工业上就是用焦炭还原铁矿石以制得生铁
C.电解熔融氧化铝时,每还原出2.7kg铝,必有300mol电子转移
D.工业上常用电解熔融NaCl的方法制取金属钠
难度: 中等查看答案及解析
-
下列关于碳氢化合物的说法正确的是( )
A.碳氢化合物的通式为CnH2n+2
B.燃烧产物为CO2和H2O的化合物一定是碳氢化合物
C.碳原子间以单键相连的烃是烷烃
D.烷烃分子的相对分子质量一定是偶数
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.熔融状态下硫酸氢钾的电离方程式:KHSO4 = K++HSO4-
B.NaHS水解:HS-+H2O
H3O++S2-
C.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+ =Fe3++3H2O
D.碳酸电离:H2CO3
2H++CO32-
难度: 简单查看答案及解析
-
化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是( )
A.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32-+2H2O
H2CO3+2OH-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ· mol-1
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为
难度: 中等查看答案及解析
-
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
A.c(NH4+):③ > ②
B.pH:① > ② > ③
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)
Mg2+ (aq) + 2OH- (aq)向溶解方向移动
D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-)
难度: 简单查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) =2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) =CO2(g) △H2=-393.5 kJ•mol-1
(3)H2(g) +
O2(g) =H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) =CH3COOH(l)的△H为( )
A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1
C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1
难度: 中等查看答案及解析
-
在卤代烃RCH2CH2X中化学键如图,则下列说法中正确的是( )

A.当该卤代烃发生水解反应时,被破坏的键是①
B.当该卤代烃发生水解反应时,被破坏的键是①和③
C.当该卤代烃发生消去反应时,被破坏的键是①和④
D.当该卤代烃发生消去反应时,被破坏的键是①和②
难度: 中等查看答案及解析
-
下列变化只涉及物理变化的是
A.煤的干馏 B.石油的裂化 C.石油的分馏 D.乙烯聚合
难度: 中等查看答案及解析
-
表中陈述I、II均正确,且两者在反应原理上相似的是
选项
陈述I
陈述II
A
向酚酞溶液中加Na2O2,溶液先变红后褪色
向石蕊溶液中通入SO2,溶液先变红后褪色
B
将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀
将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀
C
向MgCl2溶液中加入NaOH溶液生成白色沉淀
向FeCl3溶液中加入NaOH溶液生成红褐色沉淀
D
Na投入水中产生大量气泡
Na2CO3投入盐酸中产生大量气泡
难度: 中等查看答案及解析
-
有机物
 在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中—OH有关的可能反应为
在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中—OH有关的可能反应为A.①②④⑤ B.①②③⑤ C.②③④⑤ D.①③④⑤
难度: 简单查看答案及解析
-
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
A.K+、MnO4-、Cl-、SO42-
B.Na+、CO32-、SO42-、Cl-
C.NO3-、Na+、HCO3-、Mg2+
D.Na+、NO3-、H+、SO42-
难度: 简单查看答案及解析
-
金属铜的提炼多从黄铜矿(CuFeS2)开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中发生的主要反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
A.SO2既是氧化产物又是还原产物
B.CuFeS2既是氧化剂又是还原剂
C.O2只做氧化剂
D.若有1mol O2参加反应,则反应中有4mol电子转移
难度: 中等查看答案及解析
-
已知反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是

A.由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲知,A点对应温度下的平衡常数为80
C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
D.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
难度: 简单查看答案及解析